题目内容
下列实验现象所对应的离子方程式不正确的是
| | 实 验 | 现 象 | 离子方程式 |
| A | 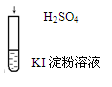 | 在空气中放置一段时间后溶液呈蓝色 | 4H+ + 4I- + O2 ="=" 2I2 + 2H2O |
| B |  | 开始时无气泡,后来有气泡 | CO32-+H+=HCO3- HCO3-+H+ ="=" H2O+CO2↑ |
| C | 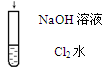 | 溶液由黄绿色变为无色 | Cl2 + 2OH- ="=" Cl- + ClO- + H2O |
| D | 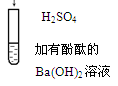 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-="=" BaSO4↓+H2O |
D
解析试题分析:A、I-在酸性条件下与空气中的氧气发生氧化还原反应生成碘,溶液变蓝,正确;B、稀盐酸滴入碳酸钠溶液中,盐酸少量,开始生成碳酸氢钠,无气泡产生,继续滴加,盐酸与碳酸氢钠反应产生二氧化碳气体,正确;C、氯水呈黄绿色,加入氢氧化钠溶液后溶液为无色,是因为氯水中的氯气与氢氧化钠反应,氯气消失,溶液黄绿色消失,正确;D、离子方程式中的阴阳离子之比不符合氢氧化钡与硫酸的化学式中的阴阳离子之比,错误,答案选D。
考点:考查离子方程式的书写的判断

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
下列反应的离子方程式正确的是
| A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
| B.铜片加入浓硝酸中:3Cu+4H++NO3-=3Cu2++NO↑+2H2O |
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH- NH3↑+H2O NH3↑+H2O |
| D.AlCl3溶液中加入足量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
能正确表示下列反应的离子方程式的是
| A.NaOH溶液中加入铝片:Al+2OH-=AlO2-+H2↑ |
B.NaHCO3溶液水解:HCO3-+H2O H3O+ +CO32- H3O+ +CO32- |
| C.NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-=CO32-+H2O |
| D.硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
在水溶液中能大量共存的一组离子是( )
| A.Na+、Ba2+、Cl—、NO3— | B.Pb2+、Hg2+、S2—、SO42— |
| C.NH4+、H+、S2O32—、PO43— | D.Ca2+、Al3+、Br—、CO32— |
下列各组离子中,在强碱性溶液中能大量共存是
| A.Na+、HCO3-、CO32-、K+ | B.K+、Ba2+、Cl-、NO3- |
| C.Na+、NO3-、K+、S2- | D.K+、NH4+、SO42-、Cl- |
下列表示对应化学反应的离子方程式正确的是
A.MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| B.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| C.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
D.NH4HCO3溶于过量的NaOH溶液中:HCO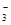 +OH-===CO +OH-===CO +H2O +H2O |
下列离子方程式错误的是
| A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42- =BaS04↓+2H2O |
| B.酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+ = 2Mn2++5O2↑+ 8H2O |
| C.等物质的量的MgCl2、Ba(OH)2和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ |
| D.铅酸蓄电池充电时的正极反应:PbSO4+ 2H2O-2e- = PbO2+4H++SO42- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 NaHSO4溶液:K+、Fe2+、NO3-、Cl- |
| B.0.1 mol·L-1NaAlO2的溶液:K+、Na+、SO42-、CO32- |
| C.无色溶液:Ba 2+、Na+、MnO4-、NO3- |
| D.由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl- |