题目内容
【题目】现有下列十种物质:①Cl2②铝③醋酸(CH3COOH)④CO2⑤H2SO4⑥熔融Ba(OH)2 ⑦氨水⑧稀硝酸⑨Al2(SO4)3固体 ⑩NaHSO4
(1)按物质的分类方法填写表格的空白处:
属于非电解质的是__________;属于弱电解质的是________;属于强电解质的是__________;能导电的是____________。
(2)写出③溶于水时的电离方程式________________________________________。
(3)实验室常用高锰酸钾固体与浓盐酸在常温下反应来快速制备少量①。反应方程式为: KMnO4 + HCl(浓) —— KCl + MnCl2 + Cl2↑ + H2O(未配平)
配平上述反应并用双线桥法标出反应中电子转移的方向和数目:____________________
KMnO4 + HCl(浓) —— KCl + MnCl2 + Cl2↑ + H2O
【答案】 ④ ③ ⑤⑥⑨⑩ ②⑥⑦⑧ CH3COOH![]() CH3COO-+H+
CH3COO-+H+ 
【解析】(1)溶于水和在熔融状态下均不能导电的化合物是非电解质,因此属于非电解质的是CO2;弱酸、弱碱以及水是弱电解质,则属于弱电解质的是醋酸;强酸、强碱大部分盐是强电解质,属于强电解质的是硫酸、熔融的氢氧化钡、硫酸铝和硫酸氢钠;含有自由移动电子或离子的物质可以导电,则能导电的是铝、熔融的氢氧化钡、氨水、稀硝酸。(2)醋酸是弱酸,部分电离,溶于水时的电离方程式为CH3COOH![]() CH3COO-+H+。(3)根据方程式可知Mn元素化合价从+7价降低到+2价,得到5个电子。Cl元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒、原子守恒可知反应中电子转移的方向和数目可表示为
CH3COO-+H+。(3)根据方程式可知Mn元素化合价从+7价降低到+2价,得到5个电子。Cl元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒、原子守恒可知反应中电子转移的方向和数目可表示为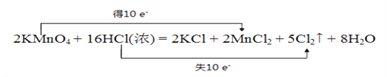 。
。

 阅读快车系列答案
阅读快车系列答案