题目内容
将足量NO2通入下列各溶液中,所含离子还能大量共存的是
| A.Fe2+、CH3COOˉ、SO42ˉ、Na+ | B.Ca2+、K+、Clˉ、HCO3ˉ |
| C.NH4+、Al3+、NO3ˉ、Clˉ | D.K+、Na+、SO32ˉ、AlO2ˉ |
C
解析试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。NO2溶于水生成硝酸和NO,则A、硝酸具有酸性和强氧化性,因此Fe2+、CH3COOˉ均不能大量共存,前者发生氧化还原反应,后者发生复分解反应,A不正确;B、硝酸能和HCO3-反应而不能大量共存,B不正确;C、NH4+、Al3+、NO3ˉ、Clˉ与硝酸均不反应,可以大量共存,C正确;D、硝酸能和SO32ˉ、AlO2ˉ反应,前者发生氧化还原反应,后者发生复分解反应,二者均不能大量共存,D不正确,答案选C。
考点:考查离子共存的正误判断

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
能用离子方程式H++OH-=H2O表示的化学反应是( )
| A.氨水和稀盐酸反应 | B.Ba(OH)2溶液和稀硫酸反应 |
| C.KOH溶液和稀盐酸反应 | D.KOH溶液和CO2反应 |
在下列溶液中,能大量共存的一组离子是
| A.pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- |
| B.通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ |
| C.c(Al3+)=0.1 mol/L的溶液中:Na+、K+、AlO2-、SO42- |
| D.由水电离出的c(H+)=1×10-13 mol/L的溶液中:Na+、HCO3-、Cl-、Br- |
下列无色透明溶液中离子能大量共存的是( )
| A.Na+、Cu2+ 、NO3-、Cl- | B.Na+、Zn2+、OH-、Br- |
| C.K +、SO42-、Cl-、Mg2+ | D.Ba2+ 、Na+ 、OH-、CO32- |
下列示意图与对应的反应情况正确的是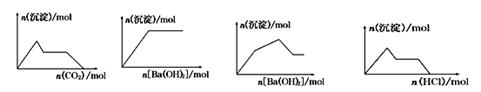
A B C D
| A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2 |
| B.NaHSO4溶液中逐滴加入Ba(OH)2溶液 |
| C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 |
| D.NaAlO2溶液中逐滴加入盐酸 |
下列离子方程式中正确的是
| A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| B.等体积、等物质的量浓度的NaHCO3溶液和Ca(OH)2溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C.向稀硫酸中加入铜粉:Cu + 2H+ = Cu2+ + H2↑ |
| D.向AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3 ↓ |
下列说法正确的是
| A.CO2的水溶液能导电,所以CO2是电解质;液溴不导电,所以液溴是非电解质 |
| B.BaSO4不溶于水,其水溶液的导电能力极弱,所以BaSO4是弱电解质 |
| C.某物质经分析,只含有一种元素,则此物质一定是一种单质 |
| D.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强 |
能在水溶液中大量共存的离子组是
| A.H+、Fe3+、ClO-、Cl- | B.H+、NH4+、Fe2+、NO3- |
| C.Ag+、K+、Cl-、SO42- | D.K+、AlO2-、Cl-、OH- |
下列离子或物质组能大量共存,进行相关操作后出现的现象或结论叙述完全正确的一组是
| 选项 | 离子或物质 | 操作、现象或结论 |
| A | Na+、 K+、Cl—、SO42— | 通入 CO2后 c(Na+)+c(K+)=c(SO42-)+ c(Cl—) +c(CO32-)成立 |
| B | NH4+、Mg2+、Cl—、NO3— | 加入铝粉能产生氢气 |
| C | K+、Cr2O72—、CH3CH2OH、SO42— | 加入盐酸后溶液褪色 |
| D | SO2、O2、NO2 | 混合气体通入足量NaOH溶液后,可能会没有任何气体剩余 |