题目内容
某化学小组准备用环己醇制备环己烯,查得相关资料如下。
反应原理: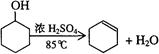
反应物与产物的物理性质:
(1)实验过程中可能发生的有机副反应的方程式为________________________________。
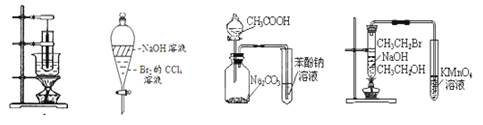
(2)根据上述资料,装置__________最适宜用来完成本次制备实验。
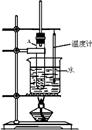
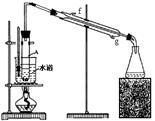
A B C
(3)制备粗产品
将5 mL________加入试管A中,再加入l0 mL_______,摇匀后放入碎瓷片,缓慢加热至反应完全。
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等。粗产品需依次经过水洗,加碳酸钠溶液洗涤以及第二次水洗。在此过程中加入碳酸钠溶液的目的是_____________;分液时,环己烯应从分液漏斗的_____(填“上”或“下”)口取出。
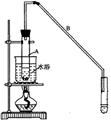
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入右图所示装置的____________(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为 。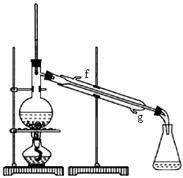
反应原理:

反应物与产物的物理性质:
| | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(2)根据上述资料,装置__________最适宜用来完成本次制备实验。



A B C
(3)制备粗产品
将5 mL________加入试管A中,再加入l0 mL_______,摇匀后放入碎瓷片,缓慢加热至反应完全。
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等。粗产品需依次经过水洗,加碳酸钠溶液洗涤以及第二次水洗。在此过程中加入碳酸钠溶液的目的是_____________;分液时,环己烯应从分液漏斗的_____(填“上”或“下”)口取出。
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入右图所示装置的____________(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为 。

(10分)(1) 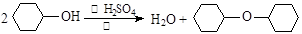 (2分)
(2分)
(2) C(2分) (3) 环己醇、浓H2SO4(浓)(2分)
(4) 除去环己烯中少量酸性杂质(1分) 上(1分) 蒸馏烧瓶(1分) 83℃(1分)
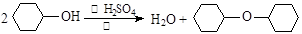 (2分)
(2分)(2) C(2分) (3) 环己醇、浓H2SO4(浓)(2分)
(4) 除去环己烯中少量酸性杂质(1分) 上(1分) 蒸馏烧瓶(1分) 83℃(1分)
试题分析:(1)醇在发生消去反应生成烯烃的同时,有可能发生分子间脱水生成醚类,所以实验过程中可能发生的有机副反应的方程式为
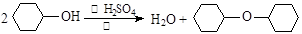 。
。(2)由于生成的环己烯的沸点为83℃,要得到液态环己烯,必须使用冷凝管,便于环己烯冷凝。又因为反应过程中还控制溶液的温度,则有必须有温度计,则答案选C。
(3)由于浓硫酸溶于水放出大量的热,且浓硫酸的密度大于水的,所以将5 mL环己醇加入试管A中,再加入l0 mL浓H2SO4,摇匀后放入碎瓷片,缓慢加热至反应完全。
(4)①由于分液后环己烯粗品中还含有少量的酸和环己醇,联想制备乙酸乙酯提纯产物时用饱和碳酸钠溶液洗涤,所以在此过程中加入碳酸钠溶液的目的是除去环己烯中少量酸性杂质。环己烯的密度小于水的,应该在上口倒出。
(5)根据装置图中仪器的结构特点可知,将混合物放入右图所示装置的蒸馏烧瓶中。环己烯的沸点是83℃,所以进行蒸馏,收集产品时,温度计显示的温度应为83℃。
点评:本题以有机合成为载体综合考查了实验室制环己烯的知识和醇、烃的性质,考查了学生组合运用实验的能力,题目难度中等。答题时注意把握实验原理和方法,特别是实验的基本操作,需要在平时的学习中注意积累。

练习册系列答案
相关题目