题目内容
【题目】碳、氢元素可形成种类繁多的烃类物质。
(1)下图表示某些烃分子的模型:
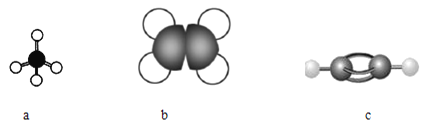
①写出a分子的空间构型______。
②c分子中的一个氢原子被![]() —取代后的物质共直线的原子最多有______个。
—取代后的物质共直线的原子最多有______个。
③取等质量的上述三种烃充分燃烧,耗氧量最大的是______(填分子式)。
④25℃和101kPa时,取a、b和c组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了56mL,原混合烃中c的体积分数为______。
(2)某烯烃的结构简式如下所示:
![]()
①用系统命名法对该烃与![]() 的加成产物命名:______,该加成产物的—氯取代物有______种。
的加成产物命名:______,该加成产物的—氯取代物有______种。
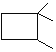
②该烯烃可以加聚生成高分子,写出该高聚物的结构简式______。该烯烃还能与乙烯以1:1比例反应形成一种环状化合物,请写出该环状化合物的键线式______。
【答案】正四面体 6 ![]() 50% 2-甲基丁烷 4
50% 2-甲基丁烷 4 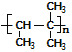
【解析】
根据球棍模型和比例模型可知,a为甲烷,b为乙烯,c为乙炔,以此分析。
(1) ①甲烷是正四面体;
②乙炔分子四原子共直线,苯分子中存在对顶角两个碳原子和两个氢原子共四原子共直线,所以乙炔分子中的一个氢原子被C6H5—取代后的物质共直线的原子最多有6个;
③等质量的烃含氢质量分数越大,耗氧量越大,所以等质量的甲烷、乙烯和乙炔充分燃烧,耗氧量最大的是CH4;
④25℃和101kPa时,根据烃CxHy燃烧通式,
CxHy+(x+![]() )O2→xCO2+
)O2→xCO2+![]() H2O △V
H2O △V
1 x+![]() x 1+
x 1+![]()
32mL 56mL
![]() =
=![]() ,解得y=3,因为CH4和C2H4都含有4个碳原子,C2H2含有2个碳原子,设C2H2所占的体积分数为x,则CH4和C2H4占(1-x),所以4(1-x)+2x=3,解得x=0.5,即原混合烃中c的体积分数为50%;
,解得y=3,因为CH4和C2H4都含有4个碳原子,C2H2含有2个碳原子,设C2H2所占的体积分数为x,则CH4和C2H4占(1-x),所以4(1-x)+2x=3,解得x=0.5,即原混合烃中c的体积分数为50%;
因此,本题正确答案为:正四面体;6;CH4;50%;
(2) ①该烃为烯烃,与H2的加成产物为烷烃,主链有四个碳原子,甲基为支链位于主链上第二个碳原子上,故命名为2-甲基丁烷,该烷烃有四种类型的氢原子,所以—氯取代物有4种;
②该烯烃可以加聚生成高分子,高聚物的结构简式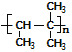 ;该烯烃与乙烯以1:1比例反应形成一种环状化合物,要断开双键形成环,故该环状化合物的键线式为
;该烯烃与乙烯以1:1比例反应形成一种环状化合物,要断开双键形成环,故该环状化合物的键线式为 。
。
因此,本题正确答案为:2-甲基丁烷;4;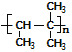 ;
; 。
。

【题目】下列实验操作能达到实验目的或得出相应结论的是
实 验 操 作 | 目的或结论 | |
A | 将Cu片放入FeCl3溶液中 | 证明Fe的金属性比Cu强 |
B | 将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成 | 镁与CO2发生置换反应 |
C | 将SO2通入溴水或酸性高锰酸钾溶液中 | 证明SO2有漂白性 |
D | 向FeCl2溶液(含少量FeBr2杂质)中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
A. A B. B C. C D. D