题目内容
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂。某课题组经查阅资料后设计合成铝氢化钠的简易流程如图所示。

已知:①AlCl3、NaH、NaAlH4遇水都能迅速发生反应。
②常温下,可用高锰酸钾、氯酸钾、重铬酸钾、次氯酸钙等与浓盐酸反应制取氯气。
(1)铝氢化钠遇水发生剧烈反应,甚至可能发生爆炸,其原因是_______________。写出铝氢化钠与水反应的化学方程式_____________________。
(2)甲同学设计实验制备无水氯化铝的装置如图所示。
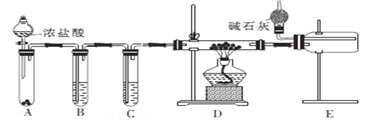
①装置E中干燥管的作用是_______________________。
②点燃装置D处酒精灯之前 需先排尽装置内的空气,其操作方法是________________。
(3)乙同学分析甲同学设计的装置后,认为只改变A、B、D中的试剂就可以用甲同学设计的装置制备NaH。
①试管B中的试剂改为____________________。
②若操作不当,则制得的NaH产品中可能含有的杂质有_________________。
(4)丙同学设计以下4种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。




从易操作性、准确性角度考虑,宜选装置________。铝氢化钠与水完全反应,冷却至室温的标志是______。
【答案】 反应放出大量热量使生成的H2迅速膨胀而爆炸 NaAlH4+2H2O═NaAlO2+4H2↑ 吸收剩余的氯气并避免空气中的水蒸气进入D中 先将装置A中的分液漏斗打开,反应一段时间,使D中玻璃管充满黄绿色气体 NaOH溶液(或其他合理答案) Na2O2(或Na等其他合理答案) 乙 连续两次读取的H2体积相等
【解析】(1)NaAlH4与水反应生成NaAlO2和H2,化学方程式为:NaAlH4+2H2O=NaAlO2+4H2↑;由已知①可得,NaAlH4遇水能迅速发生反应,放出大量热使生成的H2迅速膨胀而可能引起爆炸。
(2)由制备无水氯化铝的装置可知,A为“固-液![]() ”制Cl2装置,B为除去Cl2中HCl的装置,C为吸水干燥装置,D为Al和Cl2反应装置,E为收集AlCl3装置。①因为AlCl3遇水能迅速反应,所以E中碱石灰的作用是:吸收剩余氯气和防止空气中的水蒸气进入D中。②点燃装置D处酒精灯之前,先打开装置A中的分液漏斗,反应一段时间,使D中玻璃管充满黄绿色气体,从而排尽装置内的空气。
”制Cl2装置,B为除去Cl2中HCl的装置,C为吸水干燥装置,D为Al和Cl2反应装置,E为收集AlCl3装置。①因为AlCl3遇水能迅速反应,所以E中碱石灰的作用是:吸收剩余氯气和防止空气中的水蒸气进入D中。②点燃装置D处酒精灯之前,先打开装置A中的分液漏斗,反应一段时间,使D中玻璃管充满黄绿色气体,从而排尽装置内的空气。
(3)①若用上述装置制备NaH,只要将A中试剂改为金属锌,B中用NaOH等碱性溶液除去挥发出的HCl气体,D中试剂改为金属钠,就可以达到目的。②该装置无法隔绝氧气,,若操作不当,可能会使NaH中含有Na2O2杂质;若氢气不足,Na会有剩余。
(4)丙同学是用测氢气体积的方法来测定NaH样品纯度的,甲装置会导致内部压强大于大气压强,丙装置无法测氢气的体积,丁装置与甲装置类似,会导致结果偏大,故选乙装置;若两次测得的氢气体积相同,则说明已冷却至室温。




