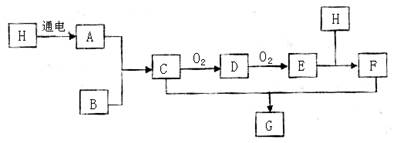
题目内容
(6分)工业上用NH3、氧气和水作原料,合成化肥硝酸铵100 t。
(1)需要NH3 吨,需要氧气 吨。
(2)若NH3制NO转化率为96%,NO制HNO3转化率为92%,需要NH3 吨(保留两位小数)。
(1)需要NH3 吨,需要氧气 吨。
(2)若NH3制NO转化率为96%,NO制HNO3转化率为92%,需要NH3 吨(保留两位小数)。
(1)42.5 80 (2)45.31
(1)工业生成硝酸铵的反应式为NH3+HNO3=NH4NO3,硝酸铵的物质的量是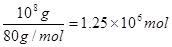 ,所以根据原子守恒可知需要氨气的物质的量是
,所以根据原子守恒可知需要氨气的物质的量是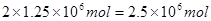 ,其质量是
,其质量是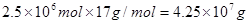 ,即为42.5吨。其中一半的氨气用来生产硝酸,另一半用来生产硝酸铵。生产硝酸的反应为4NH3+5O2
,即为42.5吨。其中一半的氨气用来生产硝酸,另一半用来生产硝酸铵。生产硝酸的反应为4NH3+5O2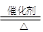 4NO+6H2O、4NO+3O2+2H2O=4HNO3。即NH3+O2=HNO3+H2O,所以需要氧气的物质的量是
4NO+6H2O、4NO+3O2+2H2O=4HNO3。即NH3+O2=HNO3+H2O,所以需要氧气的物质的量是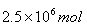 ,其质量是
,其质量是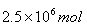 ×32g/mol=80×106g,即质量是80吨。
×32g/mol=80×106g,即质量是80吨。
(2)根据(1)的分析可知生产硝酸的理论上需要氨气是21.25吨,所以根据有关转化率可计算,生产硝酸实际需要氨气是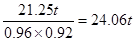 ,所以最终需要的氨气是24.06t+21.25t=45.31t。
,所以最终需要的氨气是24.06t+21.25t=45.31t。
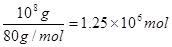 ,所以根据原子守恒可知需要氨气的物质的量是
,所以根据原子守恒可知需要氨气的物质的量是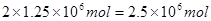 ,其质量是
,其质量是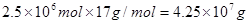 ,即为42.5吨。其中一半的氨气用来生产硝酸,另一半用来生产硝酸铵。生产硝酸的反应为4NH3+5O2
,即为42.5吨。其中一半的氨气用来生产硝酸,另一半用来生产硝酸铵。生产硝酸的反应为4NH3+5O2 4NO+6H2O、4NO+3O2+2H2O=4HNO3。即NH3+O2=HNO3+H2O,所以需要氧气的物质的量是
4NO+6H2O、4NO+3O2+2H2O=4HNO3。即NH3+O2=HNO3+H2O,所以需要氧气的物质的量是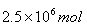 ,其质量是
,其质量是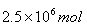 ×32g/mol=80×106g,即质量是80吨。
×32g/mol=80×106g,即质量是80吨。(2)根据(1)的分析可知生产硝酸的理论上需要氨气是21.25吨,所以根据有关转化率可计算,生产硝酸实际需要氨气是
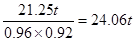 ,所以最终需要的氨气是24.06t+21.25t=45.31t。
,所以最终需要的氨气是24.06t+21.25t=45.31t。
练习册系列答案
相关题目