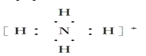题目内容
【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.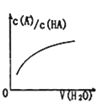 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况
的变化情况
【答案】C
【解析】
A.![]() 的燃烧热化学方程式为
的燃烧热化学方程式为![]() ①又因为
①又因为![]() ;
;![]() ②;将
②;将![]() 得
得![]() ;
;![]() ,与图象符合,A项正确;
,与图象符合,A项正确;
B.![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后,为HB、NaB的浓度都是
溶液等体积混合后,为HB、NaB的浓度都是![]() 的混合溶液,溶液的
的混合溶液,溶液的![]() ,说明HB为弱酸,HB的电离程度大于
,说明HB为弱酸,HB的电离程度大于![]() 的水解程度,溶液呈酸性,故
的水解程度,溶液呈酸性,故![]() ,
,![]() ,弱电解质的电离程度不大,故
,弱电解质的电离程度不大,故![]() ,B项正确;
,B项正确;
C.平衡常数越大,反应进行的程度越大,转化率与起始物质的浓度有关,平衡常数大,某一反应物的转化率不一定,平衡常数与氧化性无关,故C错误;
D.向弱酸HA的稀溶液中加水稀释,电离程度增大,溶液中![]() 增大、
增大、![]() 减小,则
减小,则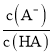 的值增大,图象与实际符合,故D正确;
的值增大,图象与实际符合,故D正确;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
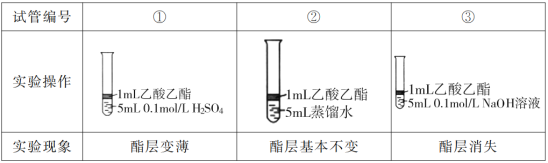
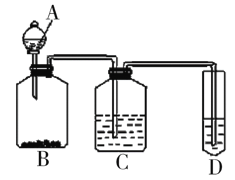
小学生10分钟应用题系列答案【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]()
项目 | 相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
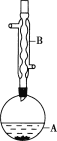
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是___。
(2)在洗涤操作中,第一次水洗和第二次水洗的主要目的分别是___。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后__(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)实验中加入少量无水MgSO4的目的是___。
(5)本实验的产率是___(填标号)。
a.30% b.40% c.60% d.90%