题目内容
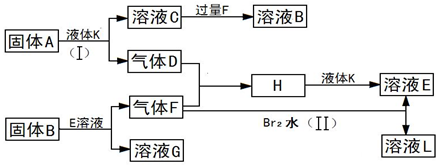
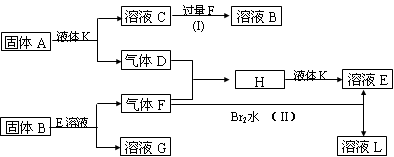
在一定条件下,下列各物质(均为中学化学常见物质,其中A是淡黄色固体.)可发生如下图所示的变化(反应中生成的水未写出):
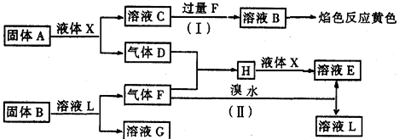
请回答下列问题:
(1)固体A是
(2)反应(Ⅰ)的离子方程式为
(3)H与液体X反应的化学方程式为

请回答下列问题:
(1)固体A是
Na2O2
Na2O2
(填化学式),A中含有的化学键为离子键和共价键
离子键和共价键
(填化学键类型).(2)反应(Ⅰ)的离子方程式为
OH-+SO2 =HSO3-
OH-+SO2 =HSO3-
;反应(Ⅱ)的化学方程式为SO2+Br2+2H2O=H2SO4+2HBr
SO2+Br2+2H2O=H2SO4+2HBr
.(3)H与液体X反应的化学方程式为
SO3+H2O=H2SO4
SO3+H2O=H2SO4
;固体B与溶液L反应的离子方程式为HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
.分析:A是淡黄色固体,应为Na2O2,能与水反应,则X为H2O,则C为NaOH,D为O2,气体F能与O2和溴水反应,则说明气体F具有还原性,则F应为SO2,H为SO3,NaOH与SO2过量反应生成NaHSO3,则B为NaHSO3,G为NaBr,E为H2SO4,L为HBr,结合物质的性质解答该题.
解答:解:A是淡黄色固体,应为Na2O2,能与水反应,则X为H2O,则C为NaOH,D为O2,气体F能与O2和溴水反应,则说明气体F具有还原性,则F应为SO2,H为SO3,NaOH与SO2过量反应生成NaHSO3,则B为NaHSO3,G为NaBr,E为H2SO4,L为HBr,则
(1)A为Na2O2,为离子化合物,含有离子键和共价键,故答案为:Na2O2;离子键和共价键;
(2)反应(Ⅰ)为NaOH与SO2过量反应生成NaHSO3,反应的离子方程式为OH-+SO2 =HSO3-,
反应(Ⅱ)为SO2与溴水的反应,生成HBr和H2SO4,反应的化学方程式为SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:OH-+SO2 =HSO3-;SO2+Br2+2H2O=H2SO4+2HBr;
(3)H为SO3,与水反应生成H2SO4,反应的化学方程式为SO3+H2O=H2SO4,
B为NaHSO3,L为HBr,反应生成SO2,反应的离子方程式为HSO3-+H+=SO2↑+H2O,
故答案为:SO3+H2O=H2SO4;HSO3-+H+=SO2↑+H2O.
(1)A为Na2O2,为离子化合物,含有离子键和共价键,故答案为:Na2O2;离子键和共价键;
(2)反应(Ⅰ)为NaOH与SO2过量反应生成NaHSO3,反应的离子方程式为OH-+SO2 =HSO3-,
反应(Ⅱ)为SO2与溴水的反应,生成HBr和H2SO4,反应的化学方程式为SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:OH-+SO2 =HSO3-;SO2+Br2+2H2O=H2SO4+2HBr;
(3)H为SO3,与水反应生成H2SO4,反应的化学方程式为SO3+H2O=H2SO4,
B为NaHSO3,L为HBr,反应生成SO2,反应的离子方程式为HSO3-+H+=SO2↑+H2O,
故答案为:SO3+H2O=H2SO4;HSO3-+H+=SO2↑+H2O.
点评:本题考查无机物的额推断,题目难度中等,本题注意把握反应的现象,结合物质的化学性质以及转化关系进行判断,学习中注意把握相关知识的积累.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
 甲、乙、丙、丁、戊是五种短周期元素,其原子序数依次增大,它们可以组成下列框图所有物质.甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,丁元素原子的最外层电子数是其电子层数的2倍,框图中溶液M为黄绿色.在一定条件下,下列各物质可发生如图所示的变化.试回答:
甲、乙、丙、丁、戊是五种短周期元素,其原子序数依次增大,它们可以组成下列框图所有物质.甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,丁元素原子的最外层电子数是其电子层数的2倍,框图中溶液M为黄绿色.在一定条件下,下列各物质可发生如图所示的变化.试回答: