题目内容
【题目】过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
(1)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是_____。
①苯与B3N3H6的总电子数相等;
②甲醛、苯分子中碳原子均采用sp3杂化;
③苯、二氧化碳、水和甲醛都是非极性分子;
④水的沸点比甲醛高得多,是因为水分子间能存在氢键,甲醛分子间不存在氢键。
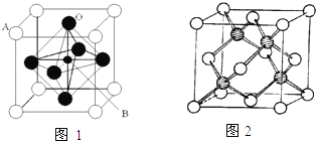
(2)2007年诺贝尔物理学奖为法国科学家阿尔贝费尔和德国科学家彼得格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca,Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
①用A,B,O表示这类特殊晶体的化学式:_______ 。
②Cr、Mn的核外特征电子排布式分别为:Cr:[Ar]3d54s1、Mn:[Ar]3d54s2,则它们第一电离能由小到大的排列顺序是:_______用“<”排列)。
(3)CO2的空间构型为______;固体CO2与SiO2熔沸点差异很大的原因是________
(4)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图2)类似,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有__个水分子;冰晶胞与金刚石晶胞微粒排列方式相同的原因是_______ 。
【答案】①④ ABO3 Cr<Mn 直线型分子 CO2是分子间作用力形成的分子晶体,SiO2是共价键形成的空间网状原子晶体 8 水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键,且为正四面体结构
【解析】
(1)①苯的电子总数为6×6+6=42,B3N3H6的的电子总数为3×5+3×7+6=42;
②甲醛、苯分子中碳原子均形成3个σ键,二氧化碳中碳原子均形成2个σ键,均没有孤电子对;
③分子中正负电荷中心重合的为非极性分子,正负电荷中心不重合的为极性分子;
④水分子之间形成氢键,沸点较高;
(2)①利用均摊法计算晶胞中所含各原子的个数,再根据原子数之比确定化学式;
②Mn的4s上有2个电子,4s处于全充满,较稳定;Cr的4s上只有1个电子。
(3)根据价层电子对互斥理论确定其空间构型,根据不同类型晶体的性质差异比较熔沸点;
(4)利用均摊法确定每个冰晶胞含有的水分子个数,根据氧原子和碳原子的杂化方式以及氢键的特点,分析冰晶胞与金刚石晶胞微粒排列方式相同的原因。
(1)①苯的电子总数为6×6+6=42,B3N3H6的的电子总数为3×5+3×7+6=42,所以苯与B3N3H6的总电子数相等,故①正确;
②甲醛、苯分子中碳原子均形成3个σ键,二氧化碳中碳原子形成2个σ键,均没有孤电子对,甲醛、苯分子中碳原子采用sp2杂化,二氧化碳分子中C原子采取sp杂化,故②错误;
③苯、二氧化碳分子的空间结构对称是非极性分子,甲醛分子的空间结构不对称属于极性分子,水分子中的氧原子有孤对电子,水分子为V形,水分子是极性分子,故③错误;
③水的沸点比甲醛高得多,是因为水分子间能形成氢键,故④正确。
故答案为:①④。
(2)①由图1可知,晶胞中A位于顶点,晶胞中含有A为8×1/8=1个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为6×1/2=3,则化学式为ABO3,
故答案为:ABO3。
②Mn的4s上有2个电子,4s处于全充满,较稳定;Cr的4s上只有1个电子,Cr失去4s上的1个电子形成较稳定的价电子结构(3d5);第一电离能由小到大的排列顺序为:Cr<Mn,故答案为:Cr<Mn。
(3)二氧化碳分子中碳原子价层电子对数是2,且不含孤电子对,所以其空间构型是直线形。CO2是分子晶体,分子间是范德华力,SiO2是空间网状结构的原子晶体,原子之间是共价键,共价键键能远大于范德华力,所以固体CO2的熔沸点比SiO2熔沸点要小得多,
故答案为:直线型分子;CO2是分子间作用力形成的分子晶体,SiO2是共价键形成的空间网状原子晶体。
(4)每个冰晶胞平均占有分子个数=4+8×1/8+6×1/2=8,H2O的氧原子形成2个σ键、含2对孤电子对,金刚石中每个碳原子含有4个σ键且没有孤电子对,所以水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子中一个氧原子可以和另外2个水分子形成氢键,2个氢原子可以和另外2个水分子形成氢键,所以每个水分子可与相邻的4个水分子形成氢键,导致冰晶胞与金刚石晶胞微粒排列方式相似,
故答案为:8;水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键,且为正四面体结构。

 阅读快车系列答案
阅读快车系列答案