题目内容
工业上用CO生产甲醇的反应为CO(g)+2H2(g) CH3OH(g)。图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是
CH3OH(g)。图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是


图10 图11 图12
 CH3OH(g)。图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是
CH3OH(g)。图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是

图10 图11 图12
| A.CO和H2合成CH3OH的反应:△H<0,△S>0 |
| B.保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小 |
| C.图10中曲线b可表示使用了催化剂的能量变化情况 |
| D.图12中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
AB
试题分析:A项:△S<0,故错;B项: 再充入1molCO和2molH2,化学平衡正向移动,n(CH3OH)/n(CO)增大,故错。故选AB。
点评:本题考查较为综合,涉及反应热、熵、平衡移动以及电化学等知识,题目难度不大,注意把握影响平衡移动的因素以及平衡移动方向的判断。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
 CO2(g) ΔH="-393.51" kJ·mol-1
CO2(g) ΔH="-393.51" kJ·mol-1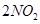
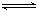
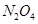
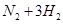
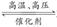
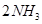
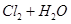
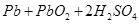
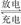
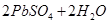

 2Z(g),减小压强时,下列说法正确的是( )
2Z(g),减小压强时,下列说法正确的是( ) 2SO3(g),进行到4 min时,测得n(SO2)="1.2" mol。下列说法正确的是 ( )
2SO3(g),进行到4 min时,测得n(SO2)="1.2" mol。下列说法正确的是 ( ) 2HI,反应进行到2min时测得反应速率v(HI)=" 0.2mol" /(L·min)。求
2HI,反应进行到2min时测得反应速率v(HI)=" 0.2mol" /(L·min)。求