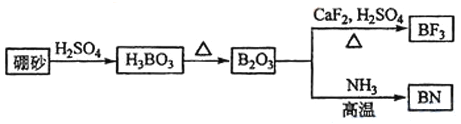
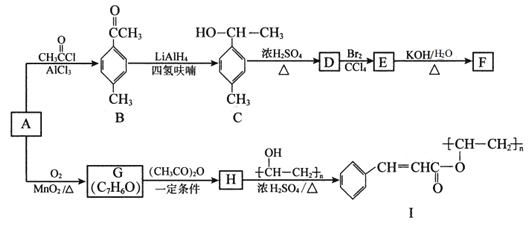
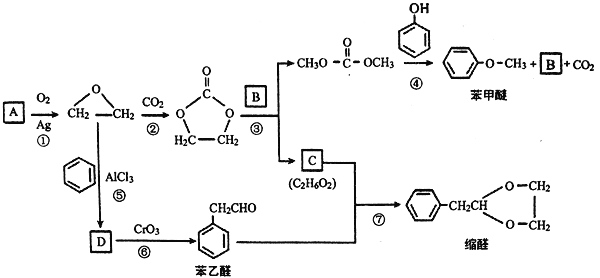
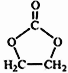
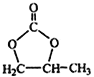
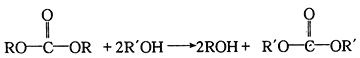题目内容
【题目】甲乙两种固体的溶解度曲线如右图所示。有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在,现将温度由80℃降到20℃。下列说法错误的是( )
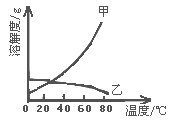
A. 杯中固体甲增多、固体乙减少
B. 杯中一定有固体甲而不一定有固体乙
C. 溶液中溶质甲减少、溶质乙增多
D. 甲和乙的两种溶液仍然一定是饱和溶液
【答案】D
【解析】A、由于甲的溶解度随温度的升高而增大,所以降温后会析出甲固体,杯中固体甲增多;由于乙的溶解度随温度的升高而减小,所以降温后变为不饱和溶液,会再溶解一部分固体乙,所以固体乙减少,故A正确;
B、由于甲的溶解度随温度的升高而增大,所以降温后会析出甲固体,杯中固体甲一定有,由于乙的溶解度随温度的升高而减小,所以降温后变为不饱和溶液,会再溶解固体乙,固体乙有可能全部溶解也有可能溶解一部分,所以不一定有固体乙,故B正确;
C、甲的溶解度随温度的升高而增大,所以降温后会析出甲固体,溶液中溶质甲减少;乙的溶解度随温度的升高而减小,所以降温后变为不饱和溶液,会再溶解固体乙,溶质乙增多;故C正确.
D、甲的溶解度随温度的升高而增大,所以降温后会析出甲固体,所以甲溶液一定饱和;乙的溶解度随温度的升高而减小,所以降温后变为不饱和溶液,会再溶解一部分固体乙,有可能固体乙全部溶解后还是不饱和,也有可能溶解固体乙后已经饱和,故D错误;

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目