题目内容
有Fe2+、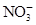 、Fe3+、
、Fe3+、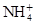 、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是( )
、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是( )
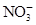 、Fe3+、
、Fe3+、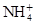 、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是( )
、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是( )| A.氧化剂与还原剂的物质的量之比为8∶1 |
B.还原产物为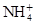 |
C.若有1 mol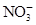 参加还原反应,转移8 mol e- 参加还原反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
A
分析各粒子的性质判断反应物和生成物,反应物应为Fe2+、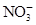 和H+,生成物应为Fe3+、
和H+,生成物应为Fe3+、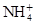 和H2O。运用得失电子守恒,配平方程式:8Fe2++
和H2O。运用得失电子守恒,配平方程式:8Fe2++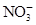 +10H+=8Fe3++
+10H+=8Fe3++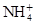 +3H2O,氧化剂
+3H2O,氧化剂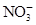 与还原剂Fe2+的物质的量之比为1∶8,A项错误;氧化剂
与还原剂Fe2+的物质的量之比为1∶8,A项错误;氧化剂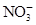 被还原得到还原产物
被还原得到还原产物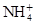 ,B项正确;若有1 mol
,B项正确;若有1 mol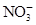 参加还原反应,则转移8 mol e-,C项正确;该氧化还原反应中氧化反应为Fe2+-e-=Fe3+,设计为原电池则为负极反应,D项正确
参加还原反应,则转移8 mol e-,C项正确;该氧化还原反应中氧化反应为Fe2+-e-=Fe3+,设计为原电池则为负极反应,D项正确
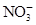 和H+,生成物应为Fe3+、
和H+,生成物应为Fe3+、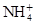 和H2O。运用得失电子守恒,配平方程式:8Fe2++
和H2O。运用得失电子守恒,配平方程式:8Fe2++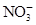 +10H+=8Fe3++
+10H+=8Fe3++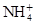 +3H2O,氧化剂
+3H2O,氧化剂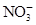 与还原剂Fe2+的物质的量之比为1∶8,A项错误;氧化剂
与还原剂Fe2+的物质的量之比为1∶8,A项错误;氧化剂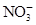 被还原得到还原产物
被还原得到还原产物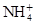 ,B项正确;若有1 mol
,B项正确;若有1 mol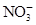 参加还原反应,则转移8 mol e-,C项正确;该氧化还原反应中氧化反应为Fe2+-e-=Fe3+,设计为原电池则为负极反应,D项正确
参加还原反应,则转移8 mol e-,C项正确;该氧化还原反应中氧化反应为Fe2+-e-=Fe3+,设计为原电池则为负极反应,D项正确
练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目

 Fe(OH)3+5OH-]
Fe(OH)3+5OH-]
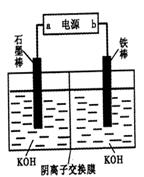
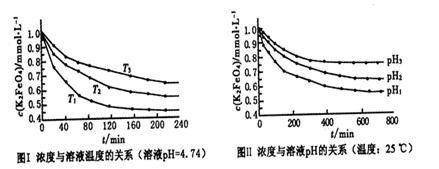

 +2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )。
+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )。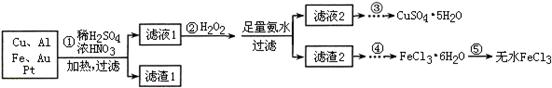
 Fe3O4+S4O62-+2H2O,有关说法正确的是
Fe3O4+S4O62-+2H2O,有关说法正确的是