题目内容
已知可逆反应:N2(g)+3H2(g)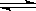 2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是( )
2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是( )
A.加压可使该反应的反应速率变大
B.升高温度,该反应的正、逆反应速率均变大
C.将1molN2和3molH2混合进行反应,反应完成时放出的热量为92kJ
D.单位时间内生成1molN2,同时消耗3molH2说明该反应达到平衡状态
【答案】
C
【解析】考查外界条件对反应速率和平衡对影响以及反应热的计算。反应有气体参加和生成,所以加压可以加快反应速率,A正确。升高温度一定加快反应速率,B正确。反应是可逆的,因此1mol氮气和3mol氢气不可能生成2mol氨气,所以放出的能量一定小于92kJ,C不正确。选项D中的反应速率方向是相反,且满足速率之比是相应的化学计量数之比,所以可以说明正逆反应速率相等,D正确。答案是C。

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
 2NH3(g)△H=-92kJ?mol-1下列关于此反应的说法中错误的是( )
2NH3(g)△H=-92kJ?mol-1下列关于此反应的说法中错误的是( ) 2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是
2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是 2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是
2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是