题目内容
已知可逆反应:N2(g)+3H2(g)  2NH3(g)△H=-92kJ?mol-1下列关于此反应的说法中错误的是( )
2NH3(g)△H=-92kJ?mol-1下列关于此反应的说法中错误的是( )
 2NH3(g)△H=-92kJ?mol-1下列关于此反应的说法中错误的是( )
2NH3(g)△H=-92kJ?mol-1下列关于此反应的说法中错误的是( )分析:A、对于有气体参加的反应,增大压强能使反应速率加快;
B、升高温度使正逆反应速率加快;
C、1molN2和3molH2混合进行反应不能完全转化;
D、转化为同种物质的反应速率,判断正逆反应速率的关系,正逆反应速率相等达到化学平衡状态.
B、升高温度使正逆反应速率加快;
C、1molN2和3molH2混合进行反应不能完全转化;
D、转化为同种物质的反应速率,判断正逆反应速率的关系,正逆反应速率相等达到化学平衡状态.
解答:解:A、该反应有气体参加,则增大压强能使反应速率加快,说法正确,故A不选;
B、升高温度使正逆反应速率加快,与放热反应无关,说法正确,故B不选;
C、热化学方程式表示完全转化的能量,1molN2和3molH2混合进行反应不能完全转化,放出的热量小于92kJ,说法错误,故C选;
D、单位时间内生成1molN2,同时消耗3molH2,由化学计量数之比等于化学反应速率之比,则氢气的正逆反应速率相等,该反应达到平衡状态,说法正确,故D不选;
故选C.
B、升高温度使正逆反应速率加快,与放热反应无关,说法正确,故B不选;
C、热化学方程式表示完全转化的能量,1molN2和3molH2混合进行反应不能完全转化,放出的热量小于92kJ,说法错误,故C选;
D、单位时间内生成1molN2,同时消耗3molH2,由化学计量数之比等于化学反应速率之比,则氢气的正逆反应速率相等,该反应达到平衡状态,说法正确,故D不选;
故选C.
点评:本题考查化学反应速率及化学平衡状态的判断,明确常见的影响因素及利用化学平衡的特征“等”和“定”来判断平衡状态是解答的关键,难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
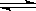 2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是( )
2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是( )  2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是
2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是 2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是
2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是