题目内容
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
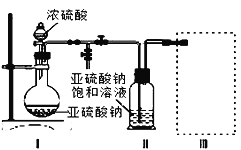
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5。
(1)加试剂前要进行的操作是_______________。
(2)浓硫酸_______ (填“能”或“不能”)用稀硫酸代替,原因是______________。
(3)从装置Ⅱ中分离出产品可采取的分离方法是_____。
(4)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为___________(填序号)。
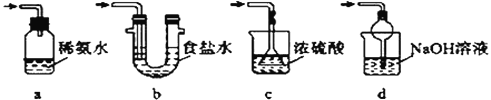
【答案】 检查装置的气密性 不能 如用稀硫酸,则生成的二氧化硫会溶解在溶液中而难以逸出 过滤 d
【解析】(1)加试剂前要进行的操作是检查装置的气密性。(2)二氧化硫易溶于水,如用稀硫酸,则生成的二氧化硫会溶解在溶液中而难以逸出,所以浓硫酸不能用稀硫酸代替。(3)从溶液中析出的晶体需要过滤得到。(4)二氧化硫是大气污染物,需要尾气处理,一般用碱液,同时还需要防止倒吸,答案选d。

练习册系列答案
相关题目