题目内容
某学生用NaHCO3和KHCO3组成的某化合物进行试验,测得如下数据(盐酸的物质的量浓度相等):
根据表中数据试计算:
(1)盐酸的物质的量浓度。
(2)混合物中NaHCO3的质量分数。
| 实验编号 | ① | ② | ③ |
| 盐酸体积 | 50mL盐酸 | 50mL盐酸 | 50mL盐酸 |
| m(混合物) | 9.2g | 16.56 g | 27.6 g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
(1)盐酸的物质的量浓度。
(2)混合物中NaHCO3的质量分数。
(1)3mol/L(2) 45.7%
⑴③中盐过量,3.36LCO2为0.15mol,0.15molHCl,盐酸的物质的量浓度0.15mol/005L=3.0mol·L-1
3.0mol·L-1的盐酸50ML最多可以生成多少CO2?
因为盐酸为0.15mol,最多可以生成0.15mol的CO2,也就是3.36L,那么3肯定不是完全反应,2嘛有可能,1那就肯定是盐酸剩余,由于1和2的CO2为2:3,所以完全反应的混合物为13.8g,
或从最先开始我们就可以根据1和2的CO2之比为2:3,而混合物之比少于2:3,就可以判断1号样品完全反应。
CO2的物质的量为0.1mol,而根据反应混合物的物质的量也应该为0.1mol。可以用差量法,也可以直接用方程。(不妨设NaHCO3物质的量为x)
84x+100(0.1-x)=9.2
x=0.05
0.1-x=0.05
ω(NaHCO3)=0.05mol×84g/mol÷(0.05mol×84g/mol+0.05mol×100g/mol)×100%=45.7%

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
 金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与水反应能够放出标准状
金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与水反应能够放出标准状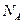 表示阿伏加德罗常数,下列说法正确的是 ( )
表示阿伏加德罗常数,下列说法正确的是 ( )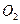 共转移
共转移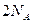 个电子
个电子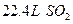 气体的质量大致相等
气体的质量大致相等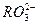 离子的质量为40g
离子的质量为40g ,则
,则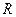 的摩尔质量为32g·mol–1
的摩尔质量为32g·mol–1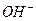 )离子
)离子