题目内容
【题目】根据题目要求,回答下列问题:
(1)下列现象和应用与电子跃迁无关的是___。
A.激光 B.焰色反应 C.燃烧放热 D.原子光谱
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用__形象化描述。
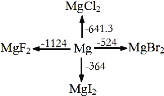
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)__I1(Cu)(填“大于”或“小于”)。原因是__。
(4)ZnF2具有较高的熔点(872℃),其化学键类型是___;
(5)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为___,![]() 原子的杂化形式为__。
原子的杂化形式为__。
(6)与H2O分子互为等电子体的阴离子为__。
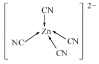
(7)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为__。
(8)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) ΔH=-313kJ/mol,F—F键的键能为159kJ/mol,Cl—Cl键的键能为242kJ/mol,则ClF3中Cl—F键的平均键能为__kJ/mol。ClF3的熔、沸点比BrF3的__(填“高”或“低”)。
【答案】C 电子云 大于 Zn核外电子排布为全满稳定结构,较难失电子 离子键 平面三角形 sp2 NH![]()
 172 低
172 低
【解析】
(1)A.电子跃迁产生光子与入射光子具有相关性.即入射光与辐射光的相位相同.如果这一过程能够在物质中反复进行,并且能用其他方式不断补充因物质产生光子而损失的能量.那么产生的光就是激光,与电子跃迁有关,故A错误;
B.当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁有关,故B错误;
C.燃烧放热是化学能转化为热能,与电子跃迁无关,故C正确;
D.原子光谱的产生是原子核电子发生能级跃迁的结果,与电子跃迁有关,故D错误;
故答案为:C;
(2) 电子在原子核外出现的概率密度分布一般用电子云描述,
故答案为:电子云;
(3) 轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大,Zn原子轨道中电子处于全满状态,Cu失去一个电子内层电子达到全充满稳定状态,所以Cu较Zn易失电子,则第一电离能Cu<Zn,
故答案为:大于;Zn核外电子排布为全满稳定结构,较难失电子;
(4) 离子晶体熔沸点较高,熔沸点较高ZnF2,为离子晶体,离子晶体中含有离子键;
故答案为:离子键;
(5) ZnCO3中,阴离子CO![]() 中C原子价层电子对个数=
中C原子价层电子对个数=![]() =3且不含孤电子对,根据价层电子对互斥理论判断碳酸根离子空间构型及C原子的杂化形式分别为平面正三角形、sp2杂化,
=3且不含孤电子对,根据价层电子对互斥理论判断碳酸根离子空间构型及C原子的杂化形式分别为平面正三角形、sp2杂化,
故答案为:平面正三角形;sp2;
(6) 原子个数相等、价电子数相等的微粒为等电子体,与水互为等电子体的微粒该是3原子最外层电子数为8的分子或离子,这样的微粒有:H2S、NH![]() ,阴离子为NH
,阴离子为NH![]() ,
,
故答案为:NH![]() ;
;
(7) [Zn(CN)4]2中锌离子提供空轨道,C原子提供电子对形成配位键,结构示意图表示为: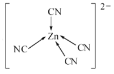 ;
;
故答案为: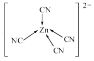 ;
;
(8) 设ClF键的平均键能为QkJmol1,则242+159×32×3×Q=313,解得Q=172;ClF3的相对分子质量比BrF3的小,ClF3分子间作用力更弱,所以ClF3的熔、沸点比BrF3的低,
故答案为:172;低;

 阅读快车系列答案
阅读快车系列答案【题目】一定条件下,可逆反应2A(g)![]() B(g)+3C(g),反应处于平衡状态的是( )
B(g)+3C(g),反应处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | v(A)=2mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
B | v(A)=2mol·L-1·min-1 | v(C)=2mol·L-1·min-1 |
C | v(A)=1mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
D | v(A)=1mol·L-1·min-1 | v(C)=1.5mol·L-1·min-1 |
A.AB.BC.CD.D
【题目】(1)某学习小组利用下图装置制取氯气并探究其性质。
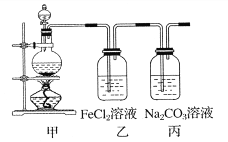
①甲装置中反应的化学方程式是_____________________________________;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)__________________________________________________________;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是____________________________________。
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
(提出假设)假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含________________;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
(进行实验)在答题卡上完成下表(不必检验Ca2+、Cl-):
实验步骤 | 预期现象和结论 | |
① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管___________________________ | 若无气体放出且澄清石灰水未见浑浊,则假设一成立;______________________________ |
② | __________________________ | ___________________________________________ |