题目内容
【题目】Ⅰ.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6﹣n]m,该物质广泛应用于日常生活用水和工业废水的处理。该物质可溶于盐酸产生相应的金属阳离子。为检测PAFC中铝和铁元素的含量,采用如图所示流程进行:
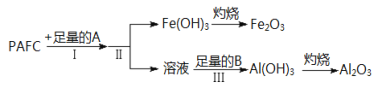
回答下列问题:
⑴PAFC中铁元素的化合价为_____,如何检验该元素的存在___________________
⑵步骤I中的试剂A是_______________(从“氢氧化钠溶液”、“氨水”中选择)步骤Ⅲ中的试剂B是_____________,离子方程式是__________
⑶步骤Ⅱ的操作是______________________
Ⅱ. ⑴甲同学用氢氧化钠溶液和氯化亚铁溶液制备氢氧化亚铁沉淀,该同学将氢氧化钠溶液加入氯化亚铁溶液中,观察到的现象是____________,反应过程中发生反应的化学方程式是_________。乙同学通过如下改进制备氢氧化亚铁:
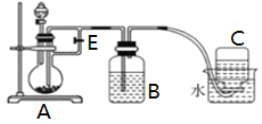
实验提供的试剂:铁屑、3mol/L硫酸溶液、NaOH溶液。请回答下列问题:
⑵①分液漏斗中盛装的试剂是______________溶液 (从“H2SO4”和“NaOH”中选择)。
②实验开始时应将止水夹E___________ (从“打开”和“关闭”中选择)。
【答案】+3价 加入KSCN,变血红色 氢氧化钠溶液 二氧化碳 AlO2- + CO2 + H2O = Al(OH)3↓ + HCO3- 过滤 有红褐色沉淀生成 4FeCl2 + O2 +2H2O +8NaOH = 4Fe(OH)3↓+8NaCl H2SO4 打开
【解析】
Ⅰ. [AlFe(OH)nCl6﹣n]m先在NaOH溶液中反应生成氢氧化铁沉淀和偏铝酸钠溶液,过滤,沉淀灼烧得到氧化铁,滤液中通入足量二氧化碳反应生成氢氧化铝和碳酸氢钠溶液,过滤,沉淀进行灼烧得到氧化铝。
Ⅱ.氯化亚铁溶液中直接滴入氢氧化钠溶液会引入空气中氧气,不能得到氢氧化亚铁沉淀,因此利用铁和稀硫酸反应生成氢气,氢气排除装置内空气,再将硫酸亚铁压入到B中氢氧化钠溶液中生成硫酸亚铁。
⑴PAFC中Cl为1价,H为+1价,O为2价,根据化合价代数和为0 ,得到铁元素的化合价为+3价,加入KSCN溶液检验,变为血红色;故答案为:+3价;加入KSCN,变血红色。
⑵根据后面生成氢氧化铁和溶液,即铝存在溶液中,因此步骤I中的试剂A是氢氧化钠溶液,铝以偏铝酸钠存在,步骤Ⅲ中的试剂B是二氧化碳,离子方程式是AlO2- + CO2 + H2O = Al(OH)3↓ + HCO3-;故答案为:氢氧化钠溶液;二氧化碳;AlO2- + CO2 + H2O = Al(OH)3↓ + HCO3-。
⑶将溶液和沉淀分离,因此步骤Ⅱ的操作是过滤;故答案为:过滤。
Ⅱ. ⑴该同学将氢氧化钠溶液加入氯化亚铁溶液中,由于亚铁离子易被氧化,因此观察到的现象是有红褐色的沉淀生成,反应过程中发生反应的化学方程式是4FeCl2 + O2 +2H2O +8NaOH = 4Fe(OH)3↓+8NaCl;故答案为:有红褐色沉淀生成;4FeCl2 + O2 +2H2O +8NaOH = 4Fe(OH)3↓+8NaCl。
⑵①利用铁与稀硫酸反应生成氢气和硫酸亚铁,生成的氢气排除装置内的空气,再关闭活塞,将硫酸亚铁压入到氢氧化钠溶液中,因此分液漏斗中盛装的试剂是H2SO4;故答案为:H2SO4。
②利用生成的氢气先排除装置内空气,因此实验开始时应将止水夹E打开;故答案为:打开。