题目内容
8.下列反应的离子方程式书写正确的是( )| A. | 过氧化钠和水反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | NH4HCO3溶液中加入过量氢氧化钠溶液:NH4++OH-═NH3•H2O | |
| C. | Ca(ClO)2溶液中通入少量二氧化碳:ClO-+H2O+CO2═HClO+CO32- | |
| D. | 向氯化铝溶液中滴入足量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
分析 A.2mol过氧化钠与水反应生成1mol氧气,该反应不满足电子守恒;
B.氢氧化钠过量,漏掉了碳酸氢根离子与氢氧根离子的反应;
C.反应生成次氯酸和碳酸钙沉淀;
D.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵.
解答 解:A.过氧化钠和水反应生成氢氧化钠和氧气,正确的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故A错误;
B.NH4HCO3溶液中加入过量氢氧化钠溶液,反应生成碳酸钠、一水合氨按和水,正确的离子方程式为:HCO3-+NH4++2OH-=NH3•H2O+H2O+CO32-,故B错误;
C.Ca(ClO)2溶液中通入少量二氧化碳,反应生成碳酸钙沉淀,正确的离子反应为:Ca2++2ClO-+H2O+CO2=2HClO+CaCO3↓,故C错误;
D.向氯化铝溶液中滴入足量氨水,反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
7.下列事实能说明金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应生成的阳离子,甲离子的化合价比乙高.
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应生成的阳离子,甲离子的化合价比乙高.
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②⑤可以 | D. | ①③④可以 |
3.等质量的下列物质中,所含分子数最多的是( )
| A. | Cl2 | B. | HCl | C. | CO2 | D. | H2 |
20.下列实验目的能够实现的是( )
| A. | 用托盘天平称取3.23 g NaCl固体 | B. | 用胶头滴管取约1 mL溶液 | ||
| C. | 向小试管中加入100 mL稀盐酸 | D. | 用50 mL量筒量取30.12 mL水 |
17.在下列环境中能大量共存的离子组是( )
| A. | 弱碱性溶液中 Na+、K+、Cl-、HCO3- | B. | 酸性溶液中 Na+、ClO-、SO42-、I- | ||
| C. | 无色溶液中 Al3+、NH4+、Cl-、OH- | D. | 无色溶液中 Fe3+、K+、Cl-、SCN- |
18.可正确表示原子轨道的是( )
| A. | n | B. | 2d | C. | 2px | D. | 3f |
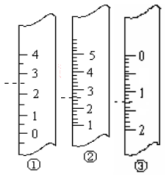 (1)如图分别是温度计、量筒、滴定管的一部分,则:温度计应该是①,读数是2.5℃,量筒应该是②,读数为2.5 mL,滴定管应该是③,读数为1.30 mL
(1)如图分别是温度计、量筒、滴定管的一部分,则:温度计应该是①,读数是2.5℃,量筒应该是②,读数为2.5 mL,滴定管应该是③,读数为1.30 mL