题目内容
NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。
(1)下列说法正确的是_________(填序号)。
A.解毒剂美蓝应该具有氧化性 B.中毒时亚硝酸盐发生氧化反应
C.解毒时高铁血红蛋白被还原 D.中毒过程中血红蛋白显氧化性
(2)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O从上述反应推知________(填序号)。
A.氧化性:I2 NaNO2 B.氧化性:NaNO2
NaNO2 B.氧化性:NaNO2 I2
I2
C.还原性:HI NO D.还原性:I2
NO D.还原性:I2 HI
HI
(3)根据上述反应,可用试纸和生活中常见的物质进行实验来鉴别NaNO2和NaCl。现供选用的物质有:①白酒 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋,进行本实验时,可以选用的物质至少有__________(填序号)。
(4)某工厂的废液中含有2%~5%的NaNO2,直接排放会造成污染。下列试剂中:①NaCl②NH4Cl ③HNO3 ④浓H2SO4,能使NaNO2转化为N2的是_______(填序号)。
(1)C(2分)
(2)BC(2分,选对一个得1分,错选一个倒扣一分)
(3)②⑤(全对得2分)
(4)②(2分)
解析试题分析:(1)NaNO2使人中毒的原因是:NaNO2把Fe2+氧化为Fe3+,NaNO2发生了还原反应,血红蛋白显示了还原性,故B、D项错误;美蓝解毒时把Fe3+还原为Fe2+,美蓝具有还原性,所以A项错,C项正确。
(2)在同一氧化还原反应中,氧化性强弱顺序为:氧化剂>氧化产物;还原性强弱顺序为:还原剂>还原产物,所以BC项正确。
(3)根据(2)中化学反应,NaNO2在酸性条件下可将I?氧化为I2,所以②⑤即可鉴别NaNO2与NaCl。
(4)NaNO2转化为N2,NaNO2作氧化剂,需要加入还原剂,故选②NH4Cl。,,,
考点:本题考查氧化还原反应的综合应用。

水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O
下列说法中,不正确的是 ( )
| A.S2O32-是还原剂 | B.Y的化学式为Fe2O3 |
| C.a=4 | D.每有1molO2参加反应,转移的电子总数为4mol |
二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO2的工艺流程图。下列有关说法正确的是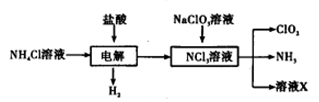
A.电解时发生反应的化学方程式为: |
| B.由NaClO3溶液制取0.6mol ClO2时,至少消耗0.1mol NCl3 |
| C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3 |
| D.溶液X的成分为NaClO3和NaOH |
As2S3和HNO3有如下反应:As2S3+10HNO3 2H3AsO4+3S+10NO2+2H2O,下列说法正确的是
| A.该反应的氧化产物仅为S |
| B.生成1molH3AsO2时。转移电子个数为10NA |
| C.将反应设计成一原电池,则NO2应该在正极附近逸出 |
| D.反应产生的NO2与56LO2混合在水中正好完全反应生成硝酸 |
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于溶液浓度不同而能发生不同氧化还原反应的是( )
| A.①③ | B.③④ | C.①② | D.①④ |
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是
| A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.4moNH3参加反应失去12mol电子 |
氧化还原反应是重要的反应类型,下列有关说法正确的是
| A.1molAl和足量的NaOH溶液反应,失去的电子数为3NA(NA表示阿伏加德罗常数) |
| B.原电池的负极发生氧化反应,电解池的阳极发生还原反应 |
| C.Cu能被FeCl3溶液腐蚀,其离子方程式为:Cu+Fe3+=Cu2++Fe2+ |
| D.Na+、Ba2+、NO3-、SO32-四种离子在溶液中因发生氧化还原反应而不能大量共存 |
 MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O