题目内容
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),如下图,则下列判断错误的是 ( )
| A.G是最活泼的非金属单质 | B.L是极性分子 |
| C.E能使紫色石蕊试液变蓝色 | D.M化学性质活泼 |
D
解析试题分析:根据E分子为三角锥,以及成键情况可知:E为NH3,含有三键并且分子的元素原子序数小于10的单质分子M是N2,直线型的极性分子单质G是F2,所以L是HF。A、氟是最活泼的非金属单质,正确;B、氟原子得电子能力强,氢化物HF稳定性好,正确;C、E为NH3,是一种碱性气体,能使紫色石蕊试液变蓝色,正确;D、M是N2,内部含有三键,键能较大,性质稳定,错误。
考点:本题考查无机物的推断、球棍模型与比例模型。

练习册系列答案
相关题目
X、Y为短周期元素,X位于第IA族,X与Y可形成化合物X2Y,下列说法不正确的是
| A.两元素还可能形成原子个数比为1:1的化合物 |
| B.X与Y的简单离子可能具有相同电子层结构 |
| C.X的原子半径一定大于Y的原子半径 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |
下列有关物质结构的说法正确的是
| A.含有离子键的化合物一定是离子化合物 |
| B.分子晶体中一定存在共价键 |
| C.H2O2分子中既存在σ键又存在π键 |
| D.晶体中分子间作用力越大,分子越稳定 |
下列性质中,可以证明某化合物内一定存在离子键的是( )
| A.可溶于水 | B.有较高的熔点 | C.水溶液能导电 | D.熔融状态能导电 |
374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH–,由此可知超临界水
| A.显中性,pH等于7 | B.表现出非极性溶剂的特性 |
| C.显酸性,pH小于7 | D.表现出极性溶剂的特性 |
科学家从化肥厂生产的(NH4)2SO4中检出化学式为N4H4(SO4)2的物质,该物质的晶体中含有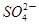 和
和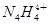 两种离子,当
两种离子,当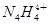 遇到碱性溶液时,会生成N4分子。下列说法正确的是
遇到碱性溶液时,会生成N4分子。下列说法正确的是
| A.14N、N4与N2互为同位素 |
B.N4H4(SO4)2的电离方程式为N4H4(SO4)2 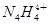 +2 +2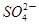 |
| C.N4H4(SO4)2不能与草木灰、K3PO4等化肥混合施用 |
| D.N4H4(SO4)2中只含有共价键,不含离子键 |
利用相似相溶原理不能解释的是
| A.I2微溶于水,易溶于CCl4;HCl易溶于水 |
| B.在水中的溶解度:C2H5OH>CH3CH2CH2CH2OH |
| C.不同的烃之间相互溶解 |
| D.I2易溶于KI溶液中 |
下列说法与键能、键长无关的是
| A.H2O的沸点比H2S的高 | B.SiC的熔点比晶体硅的高 |
| C.O2比N2的化学性质更活泼 | D.HF比HCl稳定 |
下列说法正确的是
| A.离子化合物中一定含有金属元素 | B.构成分子晶体的微粒中一定含有共价键 |
| C.原子晶体熔化要破坏共价键 | D.只有离子化合物中才存在离子 |