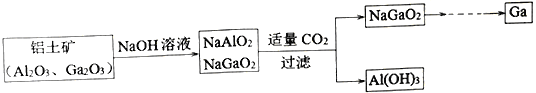
��Ŀ����
����Ŀ����¯��������Ҫ��ӦΪ��CO��g��+ ![]() Fe2O3��s��CO2��g��+
Fe2O3��s��CO2��g��+ ![]() Fe��s�� ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
Fe��s�� ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
�¶�/�� | 1000 | 1150 | 1300 |
ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
����˵����ȷ���ǣ� ��
A.����Fe2O3����������CO��ת����
B.�÷�Ӧ�ġ�H��0
C.��С�������������߷�Ӧ�����������ƽ��ת����
D.�����������ܶȺ㶨ʱ�����ܱ�־��Ӧ�ﵽƽ��״̬
���𰸡�B
���������⣺A������Fe2O3�����ѧƽ�ⲻ�ƶ�����仯���CO��ת���ʣ���A����B���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС���������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ�����Ը÷�Ӧ�ġ�H��0����B��ȷ��
C����С�����ݻ���������ѹǿ����ѧ��Ӧ�����������ڸ÷�Ӧ�������������ķ�Ӧ����ѧƽ�ⲻ�ƶ������Է�Ӧ��ת���ʲ��䣬��C����
D��CO�Ͷ�����̼���ܶȲ�ͬ����Ӧ������������ܶȲ�ͬ���������������ܶȺ㶨ʱ��˵������ֵ�Ũ�Ȳ��ٱ仯����Ӧ�ﵽƽ��״̬����D����
��ѡB��
�����㾫����ͨ��������û�ѧƽ��ļ��㣬���շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%�����Խ����⣮

����Ŀ��ijͬѧ������װ�ã��̶����������������ԣ������йذ�����ȡ��ʵ��̽�����ش��������⣮
��1������װ�â���ȡNH3 �� �䷴Ӧ�Ļ�ѧ����ʽΪ����Ҫ�ⶨ���ɵ�NH3������������ѡ���װ��������װ����ţ���װ������ʢ�Լ�Ӧ���е������� ��
��2������װ�â���ȡ���ռ������NH3 �� ��ƿ��װ���Լ��� �� ��Һ©����װ���Լ��� �� �ռ�װ��Ӧѡ������װ����ţ���֤���������ռ����IJ���������װ�âڵ������Եķ�����
��3���������и����Լ���ϣ�����������ͬ��������ȡ�����ĶԱ�ʵ�飬����������������״�������±���
�Լ����/NH3�����mL�� | 6.0gCa��OH��2��s�������� | 6.0NaOH��s�������� | 6.0g CaO��s�������� |
5.4g NH4Cl��s�� | ��/1344 | ��/1568 | ��/1792 |
5.4��NH4��2SO4��s�� | ��1364 | ��1559 | ��/1753 |
�ӱ������ݷ�����ʵ�����ư����IJ�����ߵ���ԭ���� ��