题目内容
【题目】实验室利用如图装置进行中和热的测定,请回答下列问题:
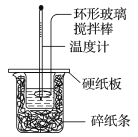
(1)做1次完整的中和热测定实验,温度计至少需使用 次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?
。
(2)实验室用50 mL 0.50 mol·L-1盐酸,50 mL 0.55 mol·L-1 NaOH溶液进行测定中和热的实验,为了把测量数据记录下来,请你设计表格。
【答案】(1)3(1分) 不同意,因为不同的温度计误差不同(1分)
(2)(3分)
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | |||||
2 | |||||
3 | |||||
【解析】(1)做1次完整的中和热测定实验,需要测量反应后的最高温度与反应前盐酸与氢氧化钠的平均温度之差,因此每次实验至少需要测定3次温度。不可使用两支温度计分别测量酸和碱的温度,因为不同的温度计误差不同。(2)测定中和热的实验需要测量反应后的最高温度与反应前盐酸与氢氧化钠的平均温度之差,据此设计表格。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
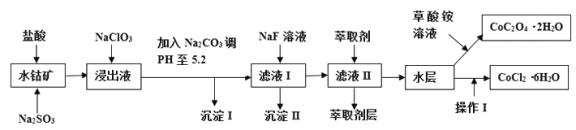
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等.
②沉淀I中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为___________。
(2)NaClO3在浸出液中发生的离子反应方程式为_________________。
(3)加入Na2CO3调PH至5.2,目的是__________________________;萃取剂层含锰元素,则沉淀II的主要成分为_____________。
(4)操作I包括:将水层加入浓盐酸调整PH为2~3,___________、____________、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是____________________(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表.
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为__。
[已知: CoC2O4·2H2O的摩尔质量为183g·mol-1]
