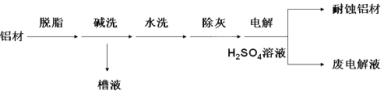
��Ŀ����
����Ŀ�������ᡢ���ᡢ��������ᶼ��ǿ�ᣬ��������ˮ��Һ�в��������ij�¶������������ڱ������еĵ��볣�����ӱ������ж�����˵������ȷ���ǣ� ��
�� | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6��10��5 | 6.3��10��9 | 1.6��10��9 | 4.2��10��10 |
A.�ڱ������У��������������ǿ
B.ˮ�������������ǿ��û����������������������������������ǿ��
C.�ڱ�������1mol/L�ĸ�����ĵ����ԼΪ0.4%
D.�ڱ�����������ĵ��뷽��ʽΪ��H2SO4�T2H++SO42��
���𰸡�D
���������⣺A���ڴ����У��������и�����ĵ���ƽ�ⳣ��������Ը������������ǿ����A��ȷ��
B������������ˮ�ж���ȫ���룬�ڱ������е���̶Ȳ�ͬ������ˮ�������������ǿ��û����������������������������������ǿ������B��ȷ��
C���ڱ������и�����������c��H+��= ![]() mol/L=4��10��3mol/L��������Ũ�ȵ��ڵ���ĸ�����Ũ�ȣ����Ը�����ĵ���̶�=
mol/L=4��10��3mol/L��������Ũ�ȵ��ڵ���ĸ�����Ũ�ȣ����Ը�����ĵ���̶�= ![]() ��100%=0.4%����C��ȷ��
��100%=0.4%����C��ȷ��
D���ڱ������У������ȫ���룬��������ĵ��뷽��ʽ��Ӧ���ÿ���ţ��ҷֲ����룬��Ҫ�Ե�һ��Ϊ������ȷ�ĵ��뷽��ʽΪ��H2SO4H++HSO4�� �� ��D����
��ѡD��
�����㾫�������ڱ��⿼������������ˮ��Һ�еĵ���ƽ�⣬��Ҫ�˽������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ�����ܵó���ȷ�𰸣�

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�����Ŀ�������п���˫��ˮ������������ƺ����ˮ��ij��ѧ��ȤС��ģ��÷�̽���й����ض����跴Ӧ���ʵ�Ӱ�죨ע�����跴Ӧ��ָ��������CN�������ķ�Ӧ����
��������ϡ�
���軯����Ҫ����CN����[Fe��CN��6]3��������ʽ���ڣ�
��Cu2+����Ϊ˫��ˮ���������账�������еĴ�����Cu2+��ƫ���������¶�˫��ˮ�ֽ�Ӱ����������Ժ��Բ��ƣ�
��[Fe��CN��6]3����CN���ѱ�˫��ˮ��������pHԽ��[Fe��CN��6]3��Խ�ȶ���Խ�ѱ�������
��ʵ����̡�
�ڳ����£����ƺ����ˮ��Ʒ������ij�ʼŨ�Ⱥʹ���Cu2+��Ũ����ͬ�����ں����ˮ��Ʒ��ͬ�ij�ʼpH��һ��Ũ��˫��ˮ��Һ��������������¶Ա�ʵ�飺
��1�����������ʵ����Ʊ������в�Ҫ���ո�
ʵ�� | ʵ��Ŀ�� | ��ʼpH | ��ˮ��Ʒ���/mL | CuSO4��Һ�����/mL | ˫��ˮ��Һ�����/mL | ����ˮ�����/mL |
�� | Ϊ����ʵ������ο� | 7 | 60 | 10 | 10 | 20 |
�� | ��ˮ�ij�ʼpH�����跴Ӧ���ʵ�Ӱ�� | 12 | 60 | 10 | 10 | 20 |
�� | 7 | 60 | 10 |
��2��ʵ���ú����ˮ�е�����Ũ�ȣ���CN����ʾ����ʱ��仯��ϵ��ͼ��ʾ��
ʵ�����20��60minʱ��η�Ӧ���ʣ��ԣ�CN����= molL��1min��1 ��
��3��ʵ��ٺ�ʵ��ڽ�������������ˮ�ij�ʼpH�������跴Ӧ���ʼ�С����ԭ������� ����һ�㼴�ɣ�����ƫ���������£������ˮ�е�CN�����ձ�˫��ˮ����ΪHCO3�� �� ͬʱ�ų�NH3 �� ��д���÷�Ӧ�����ӷ���ʽ�� ��
��4������ȤС��ͬѧҪ̽��Cu2+�Ƿ��˫��ˮ���������跴Ӧ������ã�������������ʵ�鲢��֤�������ۣ�����±������ݣ�����֪����ˮ�е�CN��Ũ�ȿ�������ɫ���Dzⶨ��
ʵ�鲽�裨��Ҫд������������̣� | Ԥ��ʵ������ͽ��� |