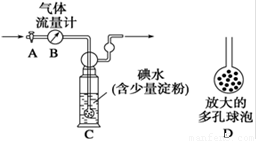
题目内容
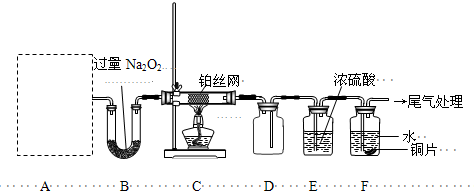
I、如下图所示,在容器A中装有20℃的水50 mL,容器B中装有1 mol/L的盐
酸50 mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平
衡:2NO2?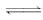 ?N2O4 ΔH=-57 kJ/mol,
?N2O4 ΔH=-57 kJ/mol,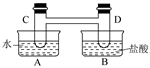
当向A中加入50 gNH4NO3晶体使之溶解;向B中加入2 g苛性钠时:
(1)C中的气体颜色__________; (填“变浅”或“变深”)。
(2)若25℃时,起始时仅有NO2气体,达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=
0.0321mol/L,则NO2的起始浓度为__________,NO2的转化率为__________。
Ⅱ. 在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
① 推进针筒后颜色变深的原因是 ;
②一段时间后气体颜色又变浅的原因是
③ 在此过程中,该反应的化学平衡常数将 (填“增大”、“减小”或“不变”,下同)NO2的转化率将 。
I.(1)变浅 (2)0.0767 mol/L 83.7%
Ⅱ.(1)①气体的体积减小,NO2浓度增大,气体的颜色加深
②增大压强,减小气体的体积,平衡向正反应方向移动 ③不变 增大
解析试题分析:I.(1)硝酸铵溶于水吸热,且该反应的正反应是放热反应,所以C中平衡向正反应方向移动,颜色变浅。
(2)达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=0.032 1 mol/L,则消耗NO2的浓度是0.032 1 mol/L×2=0.0642 mol/L,所以NO2的起始浓度是0.012 5 mol/L+0.0642 mol/L=0.0767 mol/L。则NO2的转化率为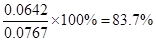 。
。
Ⅱ.(1)①气体的体积减小,因此NO2浓度增大,所以气体的颜色加深。
②增大压强,减小气体的体积,平衡向正反应方向移动,因此一段时间后气体颜色又变浅。
③平衡常数只与温度有关系,所以改变压强,平衡常数不变;平衡向正反应方向移动,所以反应物的转化率增大。
考点:考查外界条件对平衡状态的影响、转化率的计算
点评:该题是中等难度的试题,试题注重基础,侧重能力的考查和训练。该题有利于培养学生的逻辑思维能力和发散思维能力,有助于培养学生分析问题、解决问题的能力。

化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
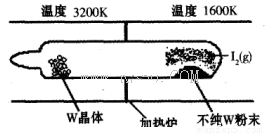
①反应(I)的平衡常数表达式K=_______,若K=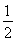 ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中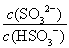 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-): n ( HSO3-) | 91:9 | 1:1 | 1:91 |
pH(25℃) | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为_________________________。
合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
|
|
甲 |
乙 |
丙 |
|
反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
|
达到平衡的时间/min |
|
5 |
8 |
|
平衡时N2的浓度/mol·L-1 |
c1 |
1.5 |
|
|
NH3的体积分数 |
ω1 |
|
ω3 |
|
混合气体密度/g·L-1 |
ρ1 |
ρ2 |
|
(1)容器乙中反应从开始到达平衡的反应速率为v(H2)=___________。
(2)在该温度下甲容器中反应的平衡常数K= (用含c1的代数式表示)。
(3)分析上表数据,下列关系正确的是________(填序号):
a.2c1 > 1.5 b.2ρ1 = ρ2 c.ω3 = ω1
II.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)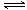 H2NCOONH4 (l) (氨基甲酸铵)
△H1
H2NCOONH4 (l) (氨基甲酸铵)
△H1
第二步:H2NCOONH4(l)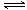 H2O(l)+H2NCONH2(l)
△H2
H2O(l)+H2NCONH2(l)
△H2
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:
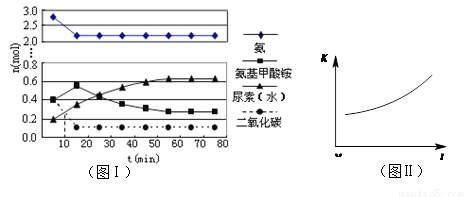
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②第二步反应的平衡常数K随温度T的变化如右上图II所示,则△H2 0;③若第一步反应升温时氨气浓度增大,请在图II中画出第一步反应K1随温度T变化曲线,并作出必要的标注。
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2。
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
该反应中的氧化剂为 (写化学式)。
②已知:N2(g)+O2(g)= 2NO(g) △H =a kJ·mol-1
N2(g)+3H2(g)= 2NH3(g) △H2=bkJ· kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = c kJ·mol-1
则4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) △H= 。
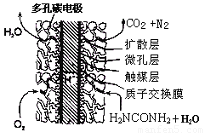
③尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为 。

 2HI(g)△H=-9.48 kJ/mol
2HI(g)△H=-9.48 kJ/mol 
 容器
容器 2HI(g) △H=-9.48 kJ/mol
2HI(g) △H=-9.48 kJ/mol