题目内容
说明可逆反应A(g)+B(g) C(g)+D(g)在一定条件下已达到化学平衡状态的事实是。
C(g)+D(g)在一定条件下已达到化学平衡状态的事实是。
A.容器内压强不随时间的变化而变化 B.容器内A、B、C、D四者共存
C.A、D的消耗速率相等 D.C、D的生成速率相等
 C(g)+D(g)在一定条件下已达到化学平衡状态的事实是。
C(g)+D(g)在一定条件下已达到化学平衡状态的事实是。 A.容器内压强不随时间的变化而变化 B.容器内A、B、C、D四者共存
C.A、D的消耗速率相等 D.C、D的生成速率相等
C
略

练习册系列答案
相关题目
 处于平衡状态(已知n+m>p),则下列说法正确的是
处于平衡状态(已知n+m>p),则下列说法正确的是  NH
NH +OH-,如进行下列操作,则NH3、NH
+OH-,如进行下列操作,则NH3、NH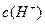 和
和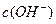 的关系如下图所示:
的关系如下图所示: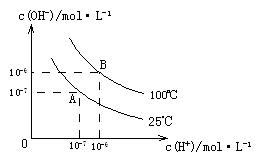
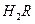 在水溶液中的电离方程式为:
在水溶液中的电离方程式为: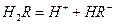 ,
,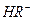

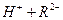 。
。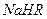 溶液中,各离子浓度由大到小的顺序是:
溶液中,各离子浓度由大到小的顺序是: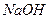 溶液的pH = 。
溶液的pH = 。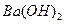 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则
溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则 2SO3,请按要求回答下列问题.
2SO3,请按要求回答下列问题. 2Z(g)+W(s) △H>0,当反应进行到2min时达到平衡,测知Z的浓度为0.2mol·L-1。下列判断正确的是
2Z(g)+W(s) △H>0,当反应进行到2min时达到平衡,测知Z的浓度为0.2mol·L-1。下列判断正确的是 2B(g) +C(g) 2C(g)
2B(g) +C(g) 2C(g) 2AB(g)达到平衡的标志是
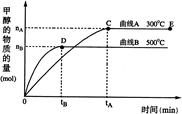
2AB(g)达到平衡的标志是 CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )
CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )