题目内容
下列说法中正确的是( )
| A.物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化 |
| B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 |
| C.吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多 |
| D.因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼 |
D
解析

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
吸热反应一定是( )。
| A.释放能量 |
| B.反应物总能量高于生成物总能量 |
| C.贮存能量 |
| D.反应物总能量低于生成物总能量 |
下列关于化学反应的描述中正确的是 ( )。
| A.需要加热才能发生的反应一定是吸热反应 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,也放出57.3 kJ的热量 |
| C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-283.0 kJ·mol-1 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则b>a |
某些化学键键能数据如下:
| 化学键 | H—H | Cl—Cl | H—Cl |
| 键能/ kJ·mol-1 | 436 | 243 | 431 |
则下列热化学方程式不正确的是 ( )
A.
 H2(g)+
H2(g)+ Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1B.H2(g)+Cl2(g)=2HCl(g)ΔH=-183 kJ·mol-1
C.
 H2(g)+
H2(g)+ Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1D.2HCl(g)=H2(g)+Cl2(g)ΔH=+183 kJ·mol-1
已知2SO2+O2 2SO3为放热反应,关于该反应的下列说法正确的是( )。
2SO3为放热反应,关于该反应的下列说法正确的是( )。
| A.O2的能量一定高于SO2的能量 |
| B.SO2和O2的总能量一定高于SO3的总能量 |
| C.SO2的能量一定高于SO3的能量 |
| D.因该反应为放热反应,故不必加热反应就可发生 |
下列反应一定属于放热反应的是( )。
| A.氢氧化钡晶体和氯化铵晶体的反应 |
B.能量变化如图所示的反应 |
| C.化学键断裂吸收的能量比化学键形成放出的能量少的反应 |
| D.不需要加热就能发生的反应 |
下列说法正确的是( )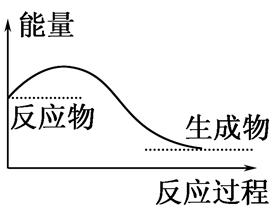
| A.任何化学反应都伴随着能量的变化 |
| B.H2O(g)―→H2O(l)的过程放出大量的热,所以该过程是化学变化 |
| C.化学反应中能量的变化都表现为热量的变化 |
| D.如图所示的是吸收能量的过程 |
已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1
③H2(g) O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
④H2O(g)=H2O(l)ΔH=-44.0 kJ·mol-1
下列结论正确的是( )
| A.碳的燃烧热大于110.5 kJ·mol-1 |
| B.浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
| C.氢气的燃烧热为241.8 kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=+571.6 kJ·mol-1 |
下列与化学反应能量变化相关的叙述正确的是 ( )。
| A.生成物总能量一定低于反应物总能量 |
| B.酒精可用作燃料,说明酒精燃烧是释放能量的反应 |
| C.干冰气化需要吸收大量的热,这个变化是吸热反应 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |