题目内容
LiAlH4是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈反应释放出氢气,LiAlH4在125℃分解为LiH、H2和Al.下列叙述错误的是( )
| A、LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 | B、LiAlH4与D2O反应,所得氢气的摩尔质量为4 g?mol-1 | C、1 mol LiAlH4在125℃完全分解,转移3 mol电子 | D、LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O═Al(OH)3+LiOH+4H2↑ |
分析:A.乙醛变化为乙醇的过程是加氢反应,是乙醛被还原发生还原反应;
B.LiH与D2O反应生成的氢气分子式为HD;
C.依据LiAlH4在125℃分解为LiH、H2和Al的化学方程式计算;
D.LiAlH4中的-1价H与H2O中的+1价H发生氧化还原反应生成H2,同时生成OH-,OH-与Al3+反应生成AlO2-.
B.LiH与D2O反应生成的氢气分子式为HD;
C.依据LiAlH4在125℃分解为LiH、H2和Al的化学方程式计算;
D.LiAlH4中的-1价H与H2O中的+1价H发生氧化还原反应生成H2,同时生成OH-,OH-与Al3+反应生成AlO2-.
解答:解:A.乙醛变成乙醇得到氢,在有机中得氢去氧是还原,所以氧化剂是乙醛,LiAlH4是还原剂,故A正确;
B.LiH与D2O反应生成氢气(HD),其摩尔质量为3 g/mol,故B错误;
C.LiAlH4中的Li、Al都是主族金属元素,H是非金属元素,故Li为+1价、Al为+3价、H为-1价,受热分解时,根据Al元素的价态变化即可得出1 mol LiAlH4在125℃时完全分解,转移3 mol电子,故C正确;
D.LiAlH4中的-1价H与H2O中的+1价H发生氧化还原反应生成H2,同时生成OH-,OH-与Al3+反应生成AlO2-,所以反应的化学方程式:LiAlH4+2H2O=LiAlO2+4H2↑,故D正确;
故选B.
B.LiH与D2O反应生成氢气(HD),其摩尔质量为3 g/mol,故B错误;
C.LiAlH4中的Li、Al都是主族金属元素,H是非金属元素,故Li为+1价、Al为+3价、H为-1价,受热分解时,根据Al元素的价态变化即可得出1 mol LiAlH4在125℃时完全分解,转移3 mol电子,故C正确;
D.LiAlH4中的-1价H与H2O中的+1价H发生氧化还原反应生成H2,同时生成OH-,OH-与Al3+反应生成AlO2-,所以反应的化学方程式:LiAlH4+2H2O=LiAlO2+4H2↑,故D正确;
故选B.
点评:本题考查了氧化还原反应的应用,明确有机反应中氧化剂和还原剂的判断、电子转移数的计算,会结合信息利用知识迁移的方法解决问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 )、LiH是金属储氢材料,又是有机合成中的常用试剂,遇水均能剧烈反应释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
)、LiH是金属储氢材料,又是有机合成中的常用试剂,遇水均能剧烈反应释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )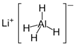 )、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
)、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )