题目内容
20.探究不同价态硫元素间的相互转化,实际上是探究含有不同价态硫元素的物质间的相互转化.亚硫酸中,硫的化合价为+4价,实验室中现有以下试剂:①溴水 ②硫化钠溶液 ③亚硫酸钠溶液 ④盐酸 ⑤浓硫酸 ⑥浓硝酸.试从其中选出一些试剂进行实验:(1)若要证明“+4价的硫”具有还原性,应选用的试剂是①③ (填相应序号,下同).实验现象是溴水橙色褪去,反应的离子方程式为Br2+SO32-+H2O=2Br-+SO42-+2H+.
(2)若要证明“+4价的硫”具有氧化性,应选用的试剂是②③④,实验现象是出现浅黄色沉淀(或溶液变浑浊),反应的离子方程式为SO32-+2H+=H2O+SO2、S2-+2H-=H2S、2H2S+SO2=3S↓+2H2O(或2S2-+SO32-+6H+=3S↓+3H2O).
分析 (1)若要证明“+4价的硫”具有还原性,可选择具有氧化性的试剂;
(2)若要证明“+4价的硫”具有氧化性,可选择具有还原性的试剂,结合发生的反应分析现象,以此来解答.
解答 解:(1)若要证明“+4价的硫”具有还原性,应选用的试剂是①③,发生离子反应为Br2+SO32-+H2O=2Br-+SO42-+2H+,观察到的现象为溴水橙色褪去,
故答案为:①③;溴水橙色褪去;Br2+SO32-+H2O=2Br-+SO42-+2H+;
(2)若要证明“+4价的硫”具有氧化性,应选用的试剂是②③④,发生的离子反应为SO32-+2H+=H2O+SO2、S2-+2H-=H2S、2H2S+SO2=3S↓+2H2O(或2S2-+SO32-+6H+=3S↓+3H2O),观察到的现象为出现浅黄色沉淀(或溶液变浑浊),
故答案为:②③④;出现浅黄色沉淀(或溶液变浑浊);SO32-+2H+=H2O+SO2、S2-+2H-=H2S、2H2S+SO2=3S↓+2H2O(或2S2-+SO32-+6H+=3S↓+3H2O).
点评 本题考查含硫物质的性质及氧化还原反应,为高频考点,把握元素的化合价及发生的氧化还原反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
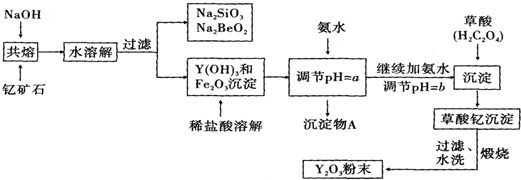
10.稀土元素是周期表中第ⅢB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的钇石矿(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
②在元素周期表中,铍和铝位于第二周期和第三周期的对角线位置,化学性质相似.
(1)钇石矿(Y2FeBe2Si2O10)的组成用氧化物的形式表示为Y2O3•FeO•2BeO•2SiO2
(2)欲从Na2SiO3和Na2BeO2的混合液中制得Be(OH)2沉淀.则
①最好选用盐酸、b(填字母)两种试剂,再经过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2气体 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O
(3)上述过程中用氨水调节pH=a的目的是使Fe3+完全水解形成沉淀而除去,a应控制在3.7~6.0范围内;写出生成沉淀物A的离子方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,检验该过程是否沉淀完全的操作方法是取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀.
(4)写出由草酸钇沉淀制备氧化钇的化学方程式Y2(C2O4)3$\frac{\underline{\;高温\;}}{\;}$Y2O3+3CO↑+3CO2↑.

已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)钇石矿(Y2FeBe2Si2O10)的组成用氧化物的形式表示为Y2O3•FeO•2BeO•2SiO2
(2)欲从Na2SiO3和Na2BeO2的混合液中制得Be(OH)2沉淀.则
①最好选用盐酸、b(填字母)两种试剂,再经过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2气体 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O
(3)上述过程中用氨水调节pH=a的目的是使Fe3+完全水解形成沉淀而除去,a应控制在3.7~6.0范围内;写出生成沉淀物A的离子方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,检验该过程是否沉淀完全的操作方法是取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀.
(4)写出由草酸钇沉淀制备氧化钇的化学方程式Y2(C2O4)3$\frac{\underline{\;高温\;}}{\;}$Y2O3+3CO↑+3CO2↑.
11.某同学用图中四种装置从海带里提取取碘,其中正确且能达到实验目的是( )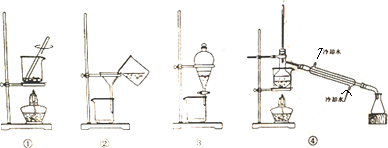

| A. | 装置①将海带灼烧成灰 | B. | 装置②过滤含I-的溶液 | ||
| C. | 装置③放出碘的CCl4溶液 | D. | 装置④分离碘并回收CCl4 |
8.25℃,向20mL 0.1mol•L-1的H3PO2溶液中滴加0.1mol•L-1的NaOH溶液(滴定过程中溶液温度保持不变),滴定曲线如图1,含磷物种浓度所占分数(δ)随pH变化关系如图2,则下列说法不正确的是( )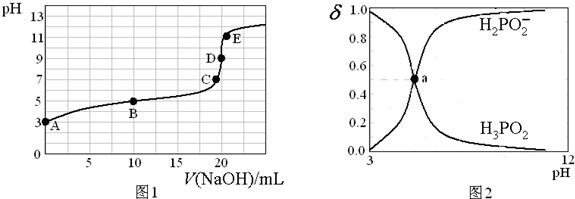

| A. | H3PO2的电离方程式为:H3PO2?H2PO2-+H+;电离常数Ka≈10-5 | |
| B. | B点溶液中存在关系:2c(H+)+c(H3PO2)=2c(OH-)+c(H2PO2-) | |
| C. | 图2中的a点对应为 图1中的B点 | |
| D. | D点时,溶液中微粒浓度大小关系为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+) |
12.对下列有机反应类型的认识,错误的是( )
| A. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应 | |
| B. | CH2=CHCH3+Br2$\stackrel{光照}{→}$CH2=CHCH2Br+HBr;加成反应 | |
| C. | 2CH3CH2OH+O2→2CH3CHO+2H2O;氧化反应 | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$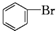 +HBr;取代反应 +HBr;取代反应 |
10.下列说法正确的是( )
| A. | 石油的成分只有烷烃 | B. | 石油裂化的过程是物理变化 | ||
| C. | 石油分馏的产品汽油是纯净物 | D. | 石油分馏过程是物理变化 |
 图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: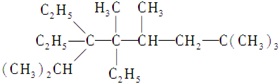 2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷,
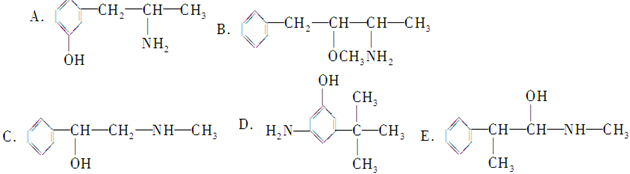
2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷, 下列各物质:与麻黄素互为同分异构体的是DE(填字母)
下列各物质:与麻黄素互为同分异构体的是DE(填字母)