题目内容
【题目】一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) ![]() CH3OH(g) △H<0
CH3OH(g) △H<0
① 该反应的平衡常数表达式为____________。
② 若容器容积不变,下列措施可增加甲醇产率的是___________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
(2)已知:① CO(g)+2H2(g) ![]() CH3OH(g) △H1 =-90.7 kJ·mol-1
CH3OH(g) △H1 =-90.7 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
③ CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
则 3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)的 △H =_______kJ·mol-1
CH3OCH3(g)+CO2(g)的 △H =_______kJ·mol-1
(3)甲醇也是新能源电池的燃料,但它对水质会造成一定的污染。有一种电化学法可消除这种污染。其原理是: 2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴 (CoSO4)混合溶液,插上两根惰性电极,通电,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程:
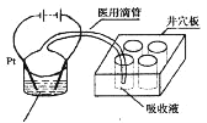
① 检验电解时产生的CO2气体,井穴板穴孔内应盛放___________溶液。
② 写出净化甲醇的离子方程式______________________。
【答案】K= ![]() BD △H=—246.1 澄清石灰水 6Co3++CH3OH + H2O=CO2↑+6 Co2++6H+
BD △H=—246.1 澄清石灰水 6Co3++CH3OH + H2O=CO2↑+6 Co2++6H+
【解析】
(1)①依据化学方程式和平衡常数概念书写平衡常数表达式;
②增加甲醇产率需要平衡正向进行,依据平衡移动原理结合反应特征是气体体积减小的放热反应分析选项判断;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)①检验二氧化碳应用澄清石灰水检验;
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+.
(1)①CO(g)+2H2(g)![]() CH3OH(g)△H<0,反应的平衡常数K=
CH3OH(g)△H<0,反应的平衡常数K=![]() ;
;
②反应是气体体积减小的放热反应,若容器容积不变,下列措施可增加甲醇产率:
A.升高温度,平衡逆向进行,甲醇产率减小,故A错误;
B.将CH3OH(g)从体系中分离,平衡正向进行,甲醇产率增大,故B正确;
C.充入He,使体系总压强增大,分压不变,平衡不移动,故C错误;
D.再充入1mol CO和3mol H2 ,反应物浓度按比例增大,相当于增大压强,平衡正向进行,甲醇产率增大,故D正确;
故答案为:BD;
(2)已知:① CO(g)+2H2(g) ![]() CH3OH(g) △H1 =-90.7 kJ·mol-1
CH3OH(g) △H1 =-90.7 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
③ CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
依据盖斯定律计算①×2+②+③得到:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的△H=-246.1KJ·mol-1;
CH3OCH3(g)+CO2(g)的△H=-246.1KJ·mol-1;
(3)①检验电解时产生的CO2气体,用澄清石灰水检验二氧化碳的存在,井穴板穴孔内应盛放澄清石灰水;
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,所以该反应离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。