题目内容
【题目】现有的氨合成气,液体燃料合成气制备工艺复杂且能耗高,中科院大连化学物理研究所提出在混合导体透氧膜反应器中一步同时制备氨合成气和液体燃料合成气的概念,并取得研究进展。其工作原理如图所示,下列说法错误的是

A. 膜I侧相当于原电池的正极
B. O2和H2O均发生还原反应
C. 膜II侧发生的反应为:CH4+O2--2e-=2H2+CO
D. 膜II侧消耗CH4与膜I侧生成H2的物质的量之比为1:2
【答案】D
【解析】A. 氧气在膜I侧被还原,所以膜I侧相当于原电池的正极,故A正确;B. O2和H2O均发生还原反应,故B正确;C. 膜II侧发生的反应为:CH4+O2--2e-=2H2+CO,故C正确;D. 膜II侧发生的反应:CH4+O2--2e-=2H2+CO,膜I侧发生的反应:H2O+2e-=H2+O2-,O2+4e-=2O2-,膜II侧每消耗1molCH4,膜I侧生成小于1molH2,故D错误。故选D。

【题目】某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡.触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性.若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是________.
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:________.
(2)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是________. 用离子方程式解释产生气泡的原因:________.
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是________.(写出一点即可)
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是________.
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
A | 正极 | NaOH | Al﹣3e﹣=Al3+ | 2H2O+2e﹣=2OH﹣+H2↑ |
B | 负极 | 稀盐酸 | 2Al﹣6e﹣=2Al3+ | 6H++6e﹣=3H2↑ |
C | 正极 | 浓硝酸 | Cu﹣2e﹣﹣=Cu2+ | 2NO3﹣+4H+﹣4e﹣=2NO2↑+2H2O |
D | 负极 | 稀硝酸 | Cu﹣2e﹣=Cu2+ | 2NO3﹣+8H+=2NO↑+4H2O+6e﹣ |
其中正确的是________,由此推知,金属作电极不仅与本身性质相关,而且与_________有关.
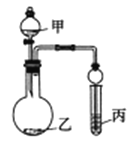
【题目】利用右图所示装置(必要时可加热)进行下列实验,能得出相应实验结论的是
选项 | 甲 | 乙 | 丙 | 实验结论 |
|
A | 苯、液溴 | 铁粉 | AgNO3溶液 | 苯与溴发生取代反应 | |
B | 浓硫酸 | Na2SO3 | 溴水 | SO2具有还原性 | |
C | 浓盐酸 | KMnO4 | 品红溶液 | Cl2具有漂白性 | |
D | 浓氨水 | 碱石灰 | Al2(SO4)3溶液 | Al(OH)3具有两性 |
A. A B. B C. C D. D
【题目】三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:

有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)仪器a的名称是_____,装置A中发生反应的化学方程式为____________。
(2)B装置的作用除观察O2的流速之外。还有____________。
(3)C装置控制反应在60℃~65℃进行,其主要目的是____________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液40.00mL,使Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是_______(填标号),滴定終点的现象为_____________。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②C1元素的质量百分含量为(列出算式)____________。
③步骤III加入硝基苯的目的是___,如无此操作,所测C1元素含量将会___(填“偏大”“偏小”或“不变”)。