题目内容
乙醇是一种可燃性液体,按一定比例混合的乙醇汽油是一种新型清洁车用燃料,某科研机构研究利用CO2合成乙醇的方法:
(i)2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH1
CH3CH2OH(g)+3H2O(g) ΔH1
原料气氢气
(ii)CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH2
CO(g)+3H2(g) ΔH2
回答下列问题:
(1)使用乙醇汽油(汽油用戊烷代替)燃料时.气缸工作时进行的反应较多,写出燃烧产生有毒气体CO、NO的所有反应的化学方程式:________________________。
(2)反应(i)中能够提高氢气转化率的措施有____。
| A.增大压强 | B.加催化剂 | C.增大CO2的浓度 | D.及时分离体系中的乙醇 |
(iii)CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3写出以CO(g)与H2(g)为原料合成乙醇的热化学方程式:___________________(焓变用
 H1、
H1、 H3表示)。
H3表示)。(4)反应(ii)中的甲烷和水蒸气是在特定的催化剂表面上进行的,该反应在不同温度下的化学平衡常数如下表:
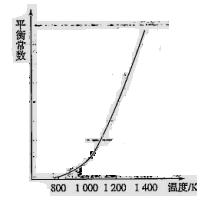
由此推知反应(ii)的焓变
 H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。
H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。(5)机动车在改用乙醇汽油后,并不能减少氮氧化物的排放。使用合适的催化剂可使NO转化为氮气,实验测得NO转化为氮气的转化率随温度变化曲线如下图所示:

由图像可知,在没有CO情况下,温度超过775K,NO的转化率减小,造成这种现象的原因可能是___________________________;在NO和CO物质的量之比为1:1的情况下,应控制的最佳温度为__________________左右。
(1)CH3CH2OH+2O2 2CO+3H2O ;2C5H12+11O2
2CO+3H2O ;2C5H12+11O2 10CO+12H2O N2+O2
10CO+12H2O N2+O2 2NO
2NO
(2)A C D
(3)2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g) ΔH1+2ΔH3
(4)> 6.75 0.3mol/( L·h)
(5)NO分解反应是放热反应,达平衡后,温度升高,则平衡逆向移动 850K(810-880K均正确)
解析试题分析:(1)燃料CH3CH2OH、C5H12不完全燃烧会产生CO。其反应方程式为:CH3CH2OH+2O2 2CO+3H2O 2C5H12+11O2
2CO+3H2O 2C5H12+11O2 10CO+12H2O在气缸内产生NO的方程式为:N2+O2
10CO+12H2O在气缸内产生NO的方程式为:N2+O2 2NO。(2)反应(i)的正反应为气体体积减小的反应。所以要提高氢气转化率可以通过增大反应物CO2的浓度、减小生成物乙醇的浓度或增大压强等措施来实现。由于催化剂能同等倍数的改变正反应、逆反应的速率,所以平衡不发生移动。乙醇选项为ACD。(3)①+③×2,整理可得:2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g) ΔH1+2ΔH3。(4)由图像可以看出:升高温度,化学平衡常数增大。即:升高温度,化学平衡向正反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动。正反应方向为吸热反应。所以反应(ii)的焓变ΔH2>0。对于反应(ⅱ)在反应开始时,c(CH4)=1mol/L;c(H2O)="1mol/L." c(CO)= c(H2)=0.当反应达到平衡时,c(CH4)=" 0.5" mol/L;c(H2O)=" 0.5" mol/L, c(CO)=" 0.5" mol/L ;c(H2)=" 1.5" mol/L。所以化学平衡常数为:
2NO。(2)反应(i)的正反应为气体体积减小的反应。所以要提高氢气转化率可以通过增大反应物CO2的浓度、减小生成物乙醇的浓度或增大压强等措施来实现。由于催化剂能同等倍数的改变正反应、逆反应的速率,所以平衡不发生移动。乙醇选项为ACD。(3)①+③×2,整理可得:2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g) ΔH1+2ΔH3。(4)由图像可以看出:升高温度,化学平衡常数增大。即:升高温度,化学平衡向正反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动。正反应方向为吸热反应。所以反应(ii)的焓变ΔH2>0。对于反应(ⅱ)在反应开始时,c(CH4)=1mol/L;c(H2O)="1mol/L." c(CO)= c(H2)=0.当反应达到平衡时,c(CH4)=" 0.5" mol/L;c(H2O)=" 0.5" mol/L, c(CO)=" 0.5" mol/L ;c(H2)=" 1.5" mol/L。所以化学平衡常数为: 。从反应开始至达到平衡时氢气的反应速率v(H2)="Δc/Δt=1.5mol/L÷5h=0.3mol/(" L·h). (5)在没有CO情况下,温度超过775K,NO的转化率减小,造成这种现象的原因可能是NO分解反应是放热反应,达平衡后,温度升高,则平衡逆向移动,导致分解率降低。由图像可以看出在NO:CO=1:1时NO的转化率随温度的升高而增大。当温度在850K时NO的转化率最大。所以应控制的最佳温度为850K左右。
。从反应开始至达到平衡时氢气的反应速率v(H2)="Δc/Δt=1.5mol/L÷5h=0.3mol/(" L·h). (5)在没有CO情况下,温度超过775K,NO的转化率减小,造成这种现象的原因可能是NO分解反应是放热反应,达平衡后,温度升高,则平衡逆向移动,导致分解率降低。由图像可以看出在NO:CO=1:1时NO的转化率随温度的升高而增大。当温度在850K时NO的转化率最大。所以应控制的最佳温度为850K左右。
考点:考查化学反应方程式、热化学方程式的书写、化学平衡移动、化学平衡常数的计算及反应条件的选择等知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:____________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g)ΔH=-90.8 kJ·mol-1
CH3OH(g)ΔH=-90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
总反应3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g)的ΔH=________;
CH3OCH3(g)+CO2(g)的ΔH=________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压
b.加入催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(4)已知反应②2CH3OH(g)??CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________;该时间内反应速率v(CH3OH)=________。
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) ="=" 2NO2(g) ΔH= + 67.7kJ·mol-1
N2H4(g) + O2(g)="=" N2(g) + 2H2O(g) ΔH= - 534.0kJ·mol-1
2NO2(g) 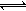 N2O4(g) ΔH=" -" 52.7kJ·mol-1
N2O4(g) ΔH=" -" 52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: ;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为: ;
(3)工业上可以用下列反应原理制备氨气:
2N2(g)+6H2O(l)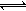 4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
①已知该反应的平衡常数K与温度的关系如图,则此反应的 Q 0 (填“>”“<”或“=”)。
②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为0.3mol/L,则用氧气表示的反应速率为 。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号).
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.v(N2)/v(O2)=2∶3 |
| C.容器中气体的密度不随时间而变化 |
| D.通入稀有气体能提高反应的速率 |
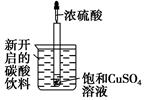
(4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。
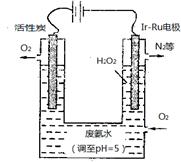
①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+) c(NO3-)(填“>”“<”或“=”);
②Ir—Ru惰性电极有吸附O2作用,该电极的电极反应为 ;
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为 。
 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为: O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,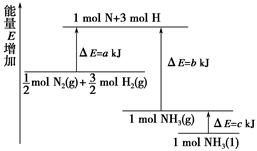
 mol N2(g)和
mol N2(g)和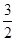 mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量。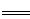 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。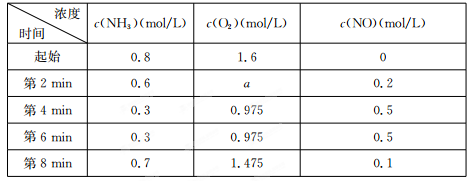
 4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
 2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1 CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1