题目内容
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为_______ ,(写出元素符号,下同),电子排布式是________________________;
B为_______,简化电子排布式是________________________;
C为_______,价电子排布式是________________________;
D为_______,电子排布图是________________________;
E为_______,原子结构示意图是________________________;
(2)A、B、C、D四种元素电负性由大到小的顺序为________________________;
(3)A、B、C、D四种元素第一电离能由小到大的顺序为_____________________
【答案】Si 1s22s22p63s23p2 Na [Ne]3s1 P 3s23p3 N ![]() Fe
Fe 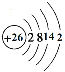 N>P>Si>Na Na<Si<P<N
N>P>Si>Na Na<Si<P<N
【解析】
K层作为内层时最多应排2个电子,对于A的原子结构示意图![]() 来说,x=2,所以A为14号元素硅,硅处于第三周期,故A、B、C都处于第三周期,同周期中除稀有气体外原子半径最大的处于IA,可确定B元素,C元素的最外层为M层,根据洪特规则分析可确定C,由此分析。
来说,x=2,所以A为14号元素硅,硅处于第三周期,故A、B、C都处于第三周期,同周期中除稀有气体外原子半径最大的处于IA,可确定B元素,C元素的最外层为M层,根据洪特规则分析可确定C,由此分析。
K层作为内层时最多应排2个电子,对于A的原子结构示意图![]() 来说,x=2,所以A为14号元素硅;因此A、B、C都处于第三周期,因B是同周期除稀有气体外半径最大的元素,所以B为钠元素;属于第三周期的C元素的最外层是M层,因有3个成单电子,所以M层电子排布图为
来说,x=2,所以A为14号元素硅;因此A、B、C都处于第三周期,因B是同周期除稀有气体外半径最大的元素,所以B为钠元素;属于第三周期的C元素的最外层是M层,因有3个成单电子,所以M层电子排布图为![]() ,故C元素为15号元素磷;又因为C、D同主族且为短周期,所以D为氮元素;由E的外围电子排布式可知其原子核外电子排布式为1s22s22p63s23p63d64s2,E为26号元素铁。结论:A是硅、B是钠、C是磷、D是氮、E是铁。
,故C元素为15号元素磷;又因为C、D同主族且为短周期,所以D为氮元素;由E的外围电子排布式可知其原子核外电子排布式为1s22s22p63s23p63d64s2,E为26号元素铁。结论:A是硅、B是钠、C是磷、D是氮、E是铁。
(1)A为硅元素,元素符号为Si,电子排布式是1s22s22p63s23p2;B为钠元素,元素符号为Na,其简化电子排布式为[Ne]3s1;C为磷元素,元素符号为P,价电子排布式是3s23p3;D为氮元素,元素符号为N,电子排布图是![]() ;E为铁元素,元素符号为Fe,原子结构示意图是
;E为铁元素,元素符号为Fe,原子结构示意图是 。
。
(2)根据元素非金属性和电负性递变规律,以及元素在周期表中位置可推知,四种元素电负性由大到小的顺序为:N>P>Si>Na;
(3)因为同周期从左至右元素第一电离能逐渐增大,IIA和VA元素反常,同主族由上而下元素的第一电离能逐渐减小。因此,这四种元素第一电离能由小到到大的顺序为:Na<Si<P<N。

【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟强碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_____。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式_____,如何检验某溶液中含该离子_____。
(3)元素Z在周期表中的位置_____,元素Z与元素T相比,非金属性较强的是_____(用元素符号表示),下列表述中能证明这一事实的是_____(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是__________。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是__________。
(3)10种元素中最高价氧化物的水化物,酸性最强的是__________。
(4)元素⑦组成的含非极性键的分子的电子式:__________。
(5)区分①、②的碳酸正盐的简单实验方法__________。
(6)①和⑤最高价氧化物对应的水化物相互反应的离子方程式为__________。
(7)③的单质与⑥的最高价氧化物反应的方程式:__________。