题目内容
【题目】以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:
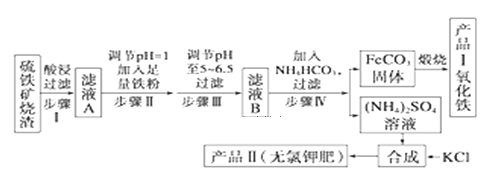
回答下列问题:
(1))古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是________(填字母) a.Fe b.FeO c.Fe2O3 d.Fe3O4
(2)酸浸、过滤后滤液A中的金属阳离子是_________,检验其中较低价态的阳离子所用试剂为________(填化学式)。煅烧FeCO3生成产品Ⅰ的化学反应方程式为_______________
(3)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为_______,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是 _____、趁热过滤、洗涤、干燥.
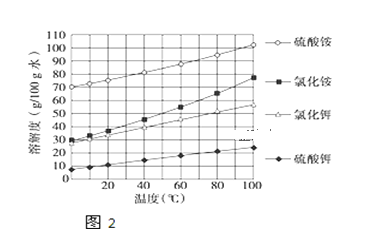
(4)进一步提纯产品Ⅱ的方法是;__________________
(5)步骤IV反应的离子方程式__________
【答案】dFe2+、Fe3+K3[Fe(CN)6]4FeCO3+O2![]() 2Fe2O3+4CO2K2SO4蒸发结晶重结晶Fe2++2HCO3-=FeCO3+CO2+H2O
2Fe2O3+4CO2K2SO4蒸发结晶重结晶Fe2++2HCO3-=FeCO3+CO2+H2O
【解析】
在矿铁中加入酸,SiO2不与酸反应,过滤后所得滤渣为SiO2,滤液A中加入过量铁粉将Fe3+还原为Fe2+,可加入氨水调节溶液pH至5~6.5,过滤后在滤液B中加入碳酸氢铵可生成FeCO3,应高温煅烧可得e2O3,硫酸铵溶液和KCl合成无氯钾肥硫酸钾,以此解答。
(1)古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁,选d,
因此,本题正确答案是:d;
(2)Fe2O3、Fe3O4、FeO能与稀硫酸反应得到Fe2+、Fe3+,SiO2不能与稀硫酸反应,因此酸浸、过滤后滤液A中含有的金属阳离子是Fe2+、Fe3+,检验Fe2+所用试剂为K3[Fe(CN)6],加入该试剂若出现蓝色沉淀,则证明含有Fe2+,
由流程图可以知道,煅烧FeCO3生成产品Ⅰ氧化铁和二氧化碳,Fe元素化合价升高,反应物中应有氧气,化学方程式为4FeCO3+O2![]() 2Fe2O3+4CO2,
2Fe2O3+4CO2,
因此,本题正确答案是:Fe2+、Fe3+;K3[Fe(CN)6];4FeCO3+O2![]() 2Fe2O3+4CO2;
2Fe2O3+4CO2;
(3)产品II是无氯钾肥,所以产品II是硫酸钾,化学式为K2SO4;
向(NH4)2SO4溶液中加入KCl溶液后,根据几种盐的溶解度曲线,可知硫酸钾的溶解度较小,氯化铵的溶解度较大,所以还需要进行的操作是蒸发结晶,将硫酸钾以晶体形式析出,趁热过滤、洗涤、干燥,即可得到产品II;
因此,本题正确答案是:K2SO4;蒸发结晶;
(4)进一步提纯产品II,则需要再次结晶,即重结晶的方法;
因此,本题正确答案是:重结晶;
(5)滤液B中含有硫酸亚铁,加入NH4HCO3溶液发生的化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+H2O,
因此步骤Ⅳ反应的离子方程式为:Fe2++2HCO3-= FeCO3↓+CO2↑+H2O,
因此,本题正确答案是:Fe2++2HCO3-= FeCO3↓+CO2↑+H2O。

 名校课堂系列答案
名校课堂系列答案【题目】已知反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为____。
(2)上述反应中的a_______0(填“大于”“小于”或“等于”)。
(3)700℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有____(填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900℃ D.使用合适的催化剂