题目内容
PCl5的热分解反应如下:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数。
(1)K=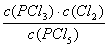 或K=
或K=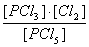 (2分)
(2分)
(2)K=0.45(2分)
解析试题分析:(1)化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是K=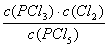 。
。
(2) PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
起始浓度(mol/L) 0.2 0 0
转化浓度(mol/L) 0.15 0.15 0.15
平衡浓度(mol/L) 0.05 0.15 0.15
所以该反应的平衡常数是
考点:考查可逆反应中平衡常数的有关计算
点评:在可逆反应的计算中,往往采用三段式进行。

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
 PCl3(g) + Cl2(g)。
PCl3(g) + Cl2(g)。 PCl3(g)
+ Cl2(g)。
PCl3(g)
+ Cl2(g)。