题目内容
【题目】现有A、B、C、D、E、F、G七种元素,其中A、B、C、D、E、F为短周期元素且原子序数依次增大;A的最高正价与最低负价的代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应;标准状况下,D2气体的密度约是1.43 g/L;E原子半径在同周期中除稀有气体外最大,F原子M层上的电子比K层多5个。金属G的合金在生活中用量最大,用途最广。
(1)画出元素F形成的简单离子结构示意图_______;
(2)若X为正盐,则其中所含的化学键类型有_______________;若X为酸式盐,则它与足量E的最高价氧化物对应水化物的稀溶液反应的离子方程式为_________________;
(3)以下三种说法中,可以验证B和F原子得电子能力强弱的是______________(填写编号)
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,F元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(4)向A和F形成的化合物的水溶液中加入少量G单质,反应后,再向溶液申加入A与D形成的化合物,发现溶液颜色变黄,请用离子方程式解释溶液变黄的原因____________。
(5)元素A和C的常见单质都是重要的化工原料,可发生反应:C2(g)+ 3A2 (g)![]() 2CA3 (g),且己知反应物总能量高于生成物总能量。
2CA3 (g),且己知反应物总能量高于生成物总能量。
①用电子式表示C2的形成过程________________。
②己知常温下拆开1 molA-A键、1 molA-C键、1mol![]() 键分别需要吸收的能量为a kJ、b kJ、c kJ,则按上述反应生成1molCA3的过程中的能量变化为:_________(填“吸收”或“放出”) ______kJ。
键分别需要吸收的能量为a kJ、b kJ、c kJ,则按上述反应生成1molCA3的过程中的能量变化为:_________(填“吸收”或“放出”) ______kJ。
【答案】 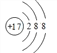 离子键、极性键(答共价键亦可) NH4++ HCO3-+2OH-= CO32-+ H2O+NH3·H2O bc 2Fe2++ H2O2+2H+= 2Fe3++ 2H2O
离子键、极性键(答共价键亦可) NH4++ HCO3-+2OH-= CO32-+ H2O+NH3·H2O bc 2Fe2++ H2O2+2H+= 2Fe3++ 2H2O ![]() 放出 (6b-3a-c)/2
放出 (6b-3a-c)/2
【解析】本题考查元素的推断,D2气体的密度约为1.43g·L-1,即D2的摩尔质量为22.4×1.43g·mol-1=32g·mol-1,即D为O,E原子半径在同周期中除稀有气体外最大,几种元素的原子序数依次增大,即E为Na, F原子M层上的电子比K层多5个,即F为Cl,金属G的合金在生活中用量最大,用途最广,因此G为Fe,A的最高正价与最低负价的代数和为0,又因为原子序数增大,因此推出A为H,B的最高价氧化物与C的氢化物在水中反应得到X,推测出X为铵盐,X既可以与酸反应又能与碱反应,因此推出B为C,C为N,(1)Cl的离子形式为Cl-,即结构示意图为 ;(2)若X为正盐,则为(NH4)2CO3,所含化学键为离子键、(极性)共价键;X为酸式盐,则为NH4HCO3,E的最高价氧化物的水化物是NaOH,反应离子反应式为NH4++HCO3-+2OH-=CO32-+H2O+NH3·H2O; (3) a、沸点是物理性质,与得电子能力强弱无关,故a错误;b、形成的化合物是CCl4,Cl显负价,说明电子对偏向Cl,即Cl的的电子能力强于C,故b正确;c、非金属性越强,其氢化物越稳定,因此比较B和F的非金属性强弱,故c错误;(4)A和F形成的化合物为HCl,加入铁单质,发生Fe+2HCl=FeCl2+H2↑,Fe2+显浅绿色,加入A与D形成的化合物,溶液的颜色变为黄色,即Fe2+→Fe3+,说明A与D形成的化合物具有氧化性,即为H2O2,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(5)①C2为N2,电子式表示形成的过程:
;(2)若X为正盐,则为(NH4)2CO3,所含化学键为离子键、(极性)共价键;X为酸式盐,则为NH4HCO3,E的最高价氧化物的水化物是NaOH,反应离子反应式为NH4++HCO3-+2OH-=CO32-+H2O+NH3·H2O; (3) a、沸点是物理性质,与得电子能力强弱无关,故a错误;b、形成的化合物是CCl4,Cl显负价,说明电子对偏向Cl,即Cl的的电子能力强于C,故b正确;c、非金属性越强,其氢化物越稳定,因此比较B和F的非金属性强弱,故c错误;(4)A和F形成的化合物为HCl,加入铁单质,发生Fe+2HCl=FeCl2+H2↑,Fe2+显浅绿色,加入A与D形成的化合物,溶液的颜色变为黄色,即Fe2+→Fe3+,说明A与D形成的化合物具有氧化性,即为H2O2,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(5)①C2为N2,电子式表示形成的过程:![]() ;②根据信息,反应物的总能量大于生成物的总能量,说明此反应是放出能量,反应物中断键吸收能量为:(3a+c)kJ·mol-1,形成化学键放出的能量为6bkJ·mol-1,此反应是放出能量,因此生成2molNH3是放出能量为(6b-3a-c)kJ·mol-1,则生成1molNH3是放出能量为(6b-3a-c)/2kJ·mol-1。
;②根据信息,反应物的总能量大于生成物的总能量,说明此反应是放出能量,反应物中断键吸收能量为:(3a+c)kJ·mol-1,形成化学键放出的能量为6bkJ·mol-1,此反应是放出能量,因此生成2molNH3是放出能量为(6b-3a-c)kJ·mol-1,则生成1molNH3是放出能量为(6b-3a-c)/2kJ·mol-1。