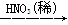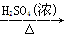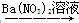题目内容
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
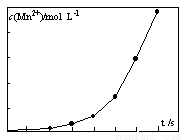
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。
(1)NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解。(2分)
(2)(NH4)2SO4(2分)
(3)【解析】
由题意知,C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
5 2
n 20.4×10-3×0.2000mol
解得 n=0.0102mol (4分)
(4)生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。(2分)
【解析】
试题分析:(1)温度不宜过高的原因除了控制沉淀的粒径外,还有NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解
(2)沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀的同时还有硫酸铵生成,所以副产品是(NH4)2SO4
(3)由题意知氧化C2O42-和Fe2+共消耗0.2000 mol·L-1标准KMnO4溶液体积30.40 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,由5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O得5C2O42-~2MnO4-,所以C2O42-的物质的量为20.4×10-3×0.2000×5/2=0.0102mol;
(4)从图像上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中若温度不变,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。
考点:考查物质制备,对操作、图像的分析,氧化还原反应对计算

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案