题目内容
20.(1)氮原子的摩尔质量是14g/mol,1mol HNO3的质量是63g,1mol HNO3约含有3NA个氧原子.(2)标准状况下11.2L HCl的物质的量是0.5mol.将这些气体溶于水中配成1L溶液,所得盐酸的物质的量浓度是0.5mol/L.
(3)2mol OH-含有的电子数为20NA.
分析 (1)摩尔质量在数值上等于相对原子质量,结合n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的构成计算;
(2)根据n=$\frac{V}{{V}_{m}}$=cV计算;
(3)1个OH-含有的电子数为10.
解答 解:(1)原氮子的摩尔质量是14g/mol,1mol HNO3的质量是1mol×63g/mol=63g,1mol HNO3约含有3mol氧原子,个数为3NA,故答案为:14g/mol;63g;3NA;
(2)n(HCl)=$\frac{11.2L}{22.4L/mol}$=0.5mol,c(HCl)=$\frac{0.5mol}{1L}$=0.5mol/L,故答案为:0.5mol;0.5mol/L;
(3)1个OH-含有的电子数为10,则2mol OH-含有的电子的物质的量为20mol,数目为20NA,故答案为:20NA.
点评 本题考查物质的量的计算,为高频考点,把握物质的量为中心的基本计算公式为解答本题的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
10.可逆反应:3A(g)?3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
| A. | B和C可能都是固体 | B. | 若C为固体,则B一定是气体 | ||
| C. | B和C一定都是气体 | D. | B和C不可能都是气体 |
11.下列关于反应热的说法正确的是( )
| A. | 可逆反应“CO(g)+H2O(g)═CO2(g)+H2(g)”中的△H小于0,说明此反应为吸热反应 | |
| B. | 已知S(s)+O2(g)═SO3(g)的反应热为△H═-385.5kJ•mol-1,说明硫的燃烧热为385.5 kJ•mol-1 | |
| C. | 一个化学反应的反应热等于反应物的总能量减去生成物的总能量 | |
| D. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
8.海洋中有丰富的食品、矿产、能源和药物.如图是从海水中提取某些原料的流程图.
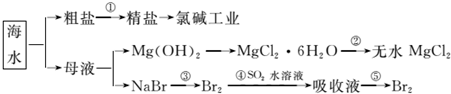
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上通过氯碱工业制取金属钠 | |
| C. | 从第③步到第⑤步的目的是浓缩、富集溴单质 | |
| D. | 第②步的反应条件是高温加热 |
15.下列物质属于纯净物的是( )
| A. | 矿泉水 | B. | 冰水混合物 | C. | 海水 | D. | 食盐水 |
5.下列说法中,不正确的是( )
| A. | 非极性键也可能存在于离子化合物中 | |
| B. | 非金属原子及其阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | 共价化合物在液态时不能导电 | |
| D. | 双原子分子中的共价键,一定是非极性键 |
12.下列说法正确的是( )
| A. | 向Na2SO4溶液中加入过量BaCl2溶液,则SO42-沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO42- | |
| B. | Ksp小的物质的溶解能力一定比Ksp大的物质的小 | |
| C. | 为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 | |
| D. | 洗涤沉淀时,洗涤次数越多越好 |
9.在四个不同的容器中,采用不同条件进行合成氨反应,根据下列在相同时间内测定的结果判断,生成氨的速率最快的是( )
| A. | 用H2表示的反应速率为0.1 mol/(L•min) | |
| B. | 用NH3表示的反应速率为0.3 mol/(L•min) | |
| C. | 用N2表示的反应速率为0.2mol/(L•min) | |
| D. | 用H2表示的反应速率为0.3 mol/(L•min) |
10.等质量的CH4和NH3相比较,下列结论错误的是( )
| A. | 二者的分子个数之比为17:16 | B. | 二者的原子个数之比为17:16 | ||
| C. | 二者的氢原子个数之比为17:12 | D. | 在相同条件下二者体积比为17:16 |