题目内容
【题目】25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
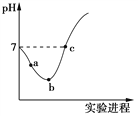
A. 实验进程中水的电离程度:a>c>b
B. c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
C. 向a点所示溶液中通入SO2,溶液的pH减小,漂白性增强
D. 由a点到b点的过程中,溶液中![]() 逐渐增大
逐渐增大
【答案】B
【解析】A.整个过程发生的反应依次为a→b发生Cl2+H2O ![]() HCl+HClO,溶液的酸性逐渐增强,水的电离程度逐渐减弱,b点形成饱和氯水,水的电离程度达到最小,然后发生HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,溶液的酸性逐渐减弱,水的电离程度又逐渐增大,因此水的电离程度:c>a>b,故A错误;B.c点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),根据物料守恒得c(Cl-)=c(ClO-)+c(HClO),所以c(Na+)=c(HClO)+2c(ClO-),故B正确;C.氯气具有氧化性,能将二氧化硫氧化为硫酸,自身被还原为盐酸,所得到的溶液不再具有漂白性,但酸性增强,故C错误;D.由a点到b点是形成饱和氯水的过程,在 b点c(HClO)浓度达到最大,因此a点到b点过程中HClO的浓度逐渐增大,HClO电离程度逐渐减小,溶液中
HCl+HClO,溶液的酸性逐渐增强,水的电离程度逐渐减弱,b点形成饱和氯水,水的电离程度达到最小,然后发生HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,溶液的酸性逐渐减弱,水的电离程度又逐渐增大,因此水的电离程度:c>a>b,故A错误;B.c点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),根据物料守恒得c(Cl-)=c(ClO-)+c(HClO),所以c(Na+)=c(HClO)+2c(ClO-),故B正确;C.氯气具有氧化性,能将二氧化硫氧化为硫酸,自身被还原为盐酸,所得到的溶液不再具有漂白性,但酸性增强,故C错误;D.由a点到b点是形成饱和氯水的过程,在 b点c(HClO)浓度达到最大,因此a点到b点过程中HClO的浓度逐渐增大,HClO电离程度逐渐减小,溶液中![]() 逐渐减小,故D错误;故选B。
逐渐减小,故D错误;故选B。

 优质课堂快乐成长系列答案
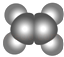
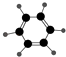
优质课堂快乐成长系列答案【题目】如表所示的是关于有机物A、B的信息:
A | B |
①能使溴的四氯化碳溶液褪色 | ①由C、H两种元素组成 |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的产物的名称为 .
(2)B具有的性质是(填序号).
①无色无味液体②有毒③不溶于水④密度比水大⑤能使酸性KMnO4溶液和溴水褪色⑥任何条件下均不与氢气反应⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物用通式CnHm表示,B的同系物用通式CxHy表示,当CnHm、CxHy分别出现同分异构体时,碳原子数的最小值n= , x= .