题目内容
【题目】下列各组离子中,在酸性溶液中能大量共存的离子组是( )
A.Na+、MnO4﹣、Mg2+、NO3﹣
B.Na+、Ba2+、SO42﹣、Br﹣
C.K+、SCN﹣、Fe3+、Cl﹣
D.K+、AlO2﹣、Cl﹣、SO42﹣
【答案】A
【解析】解:该溶液中一定存在大量的氢离子,
A.Na+、MnO4﹣、Mg2+、NO3﹣之间不发生反应,也不与氢离子反应,在溶液中能够大量共存,故A正确;
B.Ba2+、SO42﹣之间能够反应生成难溶物硫酸钡,在溶液中不能大量共存,故B错误;
C.SCN﹣、Fe3+之间能够反应硫氰化铁,在溶液中不能大量共存,故C错误;
D.AlO2﹣与氢离子反应,在溶液中不能大量共存,故D错误;
故选A.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
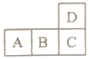
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
请判断 X、Y、Z,并用相应的元素符号回答下列问题。
(1)X是_____,它的原子M层电子数是_______。
(2)表中元素原子半径最大的是________。
(3)Y在元素周期表中的位置是第____周期第_____族,用电子式表示Y的最简单氢化物的形成过程_____。
(4)氮气中氮原子之间的化学键属于_____键,由氮气与氢气反应生成1mol氨气时转移电子的数目是______NA。
(5)硫与Z两种元素相比,非金属性强的是______,请用化学方程式说明这一结论____________。
(6)碳、氮、Y三种元素的最简单气态氢化物的稳定性由强到弱的顺序是________。由最高价碳元素与最低价氮元素组成化合物的化学式是_________。