题目内容
(13分)材料1.某温度时,在2L密闭容器中有X、Y、Z三种气态物质。实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ。
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.60 |
0.20 |
0.80 |
|
14 |
0.60 |
0.20 |
0.80 |
(1)写出该反应的热化学反应方程式: 。
(2)该温度下反应的平衡常数K= ?。

(3)若该反应的逆反应速率与时间的关系如上图所示,则:
① t2~t3时平衡向 (填“正”或“逆”)反应方向移动。
② t4时被改变的外界条件是 (选择一个正确选项)
A.升温 B. 降温 C.降压 D.移去部分反应物 E.加入负催化剂
材料2.另有实验,利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
|
实验 编号 |
温度/K |
盐酸浓度 /mol·L-1 |
醋酸浓度/mol·L-1 |
实验目的 |
|
① |
298 |
0.20 |
|
a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 |
|
② |
308 |
0.20 |
|
|
|
③ |
298 |
0.40 |
|
|
|
④ |
|
0.20 |
0.20 |
|
|
⑤ |
|
|
|
(4)请完成上工作表(填写实验④⑤的空格)。
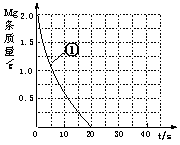
(5)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系图如图。

Ⅰ. 假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是 。
Ⅱ.若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
(共13分)
(1)X(g)+2Y(g)
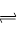 2Z(g)
△H =+300 kJ/mol (2分)
2Z(g)
△H =+300 kJ/mol (2分)
(2)160/3 (或53.3)(2分)
(3)①逆 (2分) ② B或C (2分)
(4)④ 298或308;⑤ 308或298,0.20,0.20 (共2分,全对才给分)
(5)Ⅰ. 盐酸的体积。(1分)
Ⅱ. 曲线②,起点同①,终点在横坐标10处;曲线④,应根据第⑷小题表中填写的温度确定,若为298K,则终点在横坐标40处;若为308K,则曲线与①重合,只要注明实验标号即可。(共2分,各1分)
【解析】

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案(13分)材料1.某温度时,在2L密闭容器中有X、Y、Z三种气态物质。实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ。
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.60 | 0.20 | 0.80 |
| 14 | 0.60 | 0.20 | 0.80 |
(1)写出该反应的热化学反应方程式: 。
(2)该温度下反应的平衡常数K= ?。
(3)若该反应的逆反应速率与时间的关系如上图所示,则:
① t2~t3时平衡向 (填“正”或“逆”)反应方向移动。
② t4时被改变的外界条件是 (选择一个正确选项)
A.升温 B. 降温 C.降压 D.移去部分反应物 E.加入负催化剂
材料2.另有实验,利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
| 实验 编号 | 温度/K | 盐酸浓度 /mol·L-1 | 醋酸浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.20 |
| a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 |
| ② | 308 | 0.20 |
| |
| ③ | 298 | 0.40 |
| |
| ④ |
| 0.20 | 0.20 | |
| ⑤ |
|
|
|
(4)请完成上工作表(填写实验④⑤的空格)。
(5)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系图如图。

Ⅰ. 假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是 。
Ⅱ.若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
(13分)材料1.某温度时,在2L密闭容器中有X、Y、Z三种气态物质。实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ。
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.60 | 0.20 | 0.80 |
| 14 | 0.60 | 0.20 | 0.80 |
(2)该温度下反应的平衡常数K= ?。

(3)若该反应的逆反应速率与时间的关系如上图所示,则:
① t2~t3时平衡向 (填“正”或“逆”)反应方向移动。
②t4时被改变的外界条件是 (选择一个正确选项)
| A.升温 | B.降温 | C.降压 | D.移去部分反应物 E.加入负催化剂 |
| 实验 编号 | 温度/K | 盐酸浓度 /mol·L-1 | 醋酸浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.20 | | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 |
| ② | 308 | 0.20 | | |
| ③ | 298 | 0.40 | | |
| ④ | | 0.20 | 0.20 | |
| ⑤ | | | |
(5)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系图如图。

Ⅰ. 假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是 。
Ⅱ.若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
(14分)I、某温度时,在一个2L的密闭容器中, X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为
(2)反应开始至2min,气体Z的平均反应速率为
(3)若X、Y、Z均为气体,反应达平衡时,此时容器内的压强与起始压强之比为
II、一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
|
实验序号 |
氯化镁固体中氯元素含量/% |
温度/℃ |
粉碎方式/ |
催化效果/g·g-1 |
|
1 |
70.97 |
20 |
滚动球磨 |
3.9×104 |
|
2 |
74.45 |
20 |
滚动球磨 |
5.0×104 |
|
3 |
74.45 |
20 |
振动球磨 |
5.9×104 |
|
4 |
ω |
100 |
振动球磨 |
|
注:催化效果用单位时间内每克催化剂得到产品的质量来表示。
(1)表中ω= 。
(2)从实验1、2可以得出的结论是 。
(3)设计实验2、3的目的是 。
III、现有如下两个反应:(A)NaOH + HCl = NaCl + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池________________________
(2)如果不能,说明其原因__________________________
(3)如果可以,则写出正、负极材料、电解质溶液名称______ ____。
材料1.某温度时,在2L密闭容器中有X、Y、Z三种气态物质。实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ。
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.60 | 0.20 | 0.80 |
14 | 0.60 | 0.20 | 0.80 |
(1)写出该反应的热化学反应方程式: 。
(2)该温度下反应的平衡常数K= 。
(3)若该反应的逆反应速率与时间的关系如上右图所示,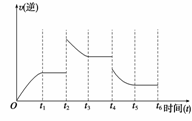 则:
则:
① t2~t3时平衡向 (填“正”或“逆”)反应方向移动。
② t4时被改变的外界条件是 (选择一个正确选项)
A.升温 B. 降温 C.降压 D.移去部分反应物 E.加入负催化剂
材料2.另有实验,利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
实验 编号 | 温度/K | 盐酸浓度 /mol·L-1 | 醋酸浓度/mol·L-1 | 实验目的 |
① | 298 | 0.20 | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 | |
② | 308 | 0.20 | ||
③ | 298 | 0.40 | ||
④ | 0.20 | 0.20 | ||
⑤ |
 (4)请完成上工作表(填写实验④⑤的空格)。
(4)请完成上工作表(填写实验④⑤的空格)。
(5)上表实验①中,镁条消失的时间为20s。实验过程中,镁
条剩余质量与时间关系图如右图。
Ⅰ. 假设反应过程中盐酸体积不变,则要计算该反应的速率
v(HCl),尚缺少的数据是 。
Ⅱ.若反应温度每升高10℃,反应速率增大到原来的2倍;温
度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图
中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与
时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁
均能完全溶解)。