题目内容
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:(1)以上步骤有错误的是(填编号)___________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)_________;
(2)判断滴定终点的现象是:锥形瓶中溶液从__________色变为__________色,且半分钟不变色;
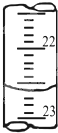
(3)下图是某次滴定时的滴定管中的液面,其读数为__________mL;
(4)根据下列数据:请计算待测盐酸溶液的浓度:__________mol/L.
滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
【答案】
(1)①偏大(2)无,粉红(3)22.60(4)0.2000
【解析】
试题分析:(1)根据碱式滴定管在装液前应用所装液体进行润洗,用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上,碱式滴定管未用标准盐酸溶液润洗就直接注入标准NaOH溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=![]() ,可知c(标准)偏大;
,可知c(标准)偏大;
(2)滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,所以当滴入最后一滴盐酸,溶液由无色变为粉红色,且半分钟内不褪色;
(3)滴定管中的液面读数为22.60mL;
(4)三次滴定消耗的体积为:20.00mL,20.00mL,22.10,舍去第3组数据,然后求出1、2组平均消耗V(NaOH)=20.00mL,c(待测)=![]() =
=![]() =0.2000molL-1。
=0.2000molL-1。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案