题目内容
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
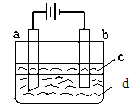
(1)b电极材料为______,其电极反应式为_____________________。
(2)(选择填空)电解时,当在电极上有白色沉淀生成时,电解液d是_____;当在两极之间的溶液中有白色沉淀生成时,电解液d是______。
A.纯水 B.NaCl溶液 C. NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是________________,在加入苯之前,对d溶液进行加热处理的目的是_______________________。
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为_________________________________。该现象的化学反应方程式为
(1)石墨,
(2)C,B
(3)隔绝空气,防止产物被氧化;赶尽溶液中的氧气
(4)白色沉淀迅速变成灰绿色,最后变为红褐色,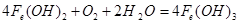
【解析】
试题分析:(1)b电极连着负极,所以是阳极,得到电子被还原,而铁是被氧化的,所以是石墨,溶液中德氢离子在阳极得到电子被还原;
(2)电解时,当在电极上有白色沉淀生成时,表明溶液中氢氧根离子很多,只能是氢氧化钠溶液;当在两极之间的溶液中有白色沉淀生成时,表明氢氧根离子是在电解过程中产生的,电解质溶液应是氯化钠。
(3)苯的密度比水的密度小,且不溶于水,可以覆盖在溶液的表面,将溶液与空气隔绝,防止空气中的氧气对溶液起到氧化作用,加热可以降低气体在水中的溶解度,从而达到赶尽溶液中氧气的目的;
(4)当用Na2SO4溶液做电解液时,水中的氢离子被还原,生成氧气,把Fe(OH)2氧化。
考点:考查铁的相关知识点。





