题目内容
【题目】下列关于热化学反应的描述中正确的是
A. 需要加热才能发生的反应一定是吸热反应
B. CO(g)的燃烧热ΔH=-283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ/mol
D. 已知在120 ℃、101 kPa下,1 g H2燃烧生成水放出121 kJ热量,其热化学方程式为H2(g)+![]() O2(g)===H2O(l) ΔH=-242 kJ·mol-1
O2(g)===H2O(l) ΔH=-242 kJ·mol-1
【答案】B
【解析】A、放热反应有的需加热,有的不需加热.如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点,再如铝热反应也是,选项A错误;B、CO的燃烧热是指1molCO完全燃烧生成稳定的氧化物CO2(g)放出的热量,故有2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0 kJ/mol,选项B正确;C、在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态H2O时的反应热叫作中和热,中和热是以生成1 mol 液态H2O为基准的,选项C错误;D. 已知在120 ℃、101 kPa下,生成的水是气态水,1 g H2燃烧生成水放出121 kJ热量,其热化学方程式为H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1,选项D错误。答案选B。
O2(g)===H2O(g) ΔH=-242 kJ·mol-1,选项D错误。答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】下列方法中,不能用于实验室制取氨的是
A. 加热试管中的氯化铵固体
B. 在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
C. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
D. 将烧瓶中的浓氨水加热
【题目】环己酮实验室合成的反应如下:
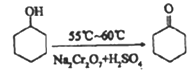
环己醇和环己酮的部分物理性质见下表:
物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm-3、20℃) | 溶解性 |
环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。其主要步骤有(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.往液体中加入NaCl固体至饱和,静置,分液
d.过滤
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分提纯步骤的正确顺序是____________________。
(2)b中水层用乙醚萃取的目的是______________________。
(3)以下关于萃取分液操作的叙述中,不正确的是______________
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
D.经几次振荡并放气后,手持分漏斗静置液体分层
(4)在上述操作c中,加入NaCl固体的作用是____________________。蒸馏除乙醚的过程中采用的加热方式为_____________________。
(5)蒸馏操作时,一段时间后发现未加沸石,应采取的正确方法是______________________。
(6)利用红外光谱可以分析出环己酮的官能团为_____________________。
