��Ŀ����
����Ŀ��NO��CO��![]() �Ǵ�����Ⱦ�ﵫ��������Ҫ��;��
�Ǵ�����Ⱦ�ﵫ��������Ҫ��;��
��֪��![]()
![]()
![]()
![]()
![]()
![]()
(1)ij��Ӧ��ƽ�ⳣ������ʽΪ ���˷�Ӧ���Ȼ�ѧ����ʽΪ��______��
���˷�Ӧ���Ȼ�ѧ����ʽΪ��______��
(2)����Ⱥ����ܱ������г��������NO��CO���з�Ӧ�����жϷ�Ӧ�Ѵﵽ��ѧƽ��״̬����______(�����)��
a.�����е�ѹǿ���ֲ��� b.![]()
c.�����ƽ����Է�����������34.2���� d.�÷�Ӧƽ�ⳣ�����ֲ���
e.NO��CO������ȱ��ֲ���
��.(3)����ת��Ϊ![]() ��CO�ķ�ӦΪ��
��CO�ķ�ӦΪ��![]()
![]()

��һ�������£�![]() ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����
��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����![]() ______
______![]() (�<����>����=��)��
(�<����>����=��)��
A��B��C���㴦��Ӧ��ƽ�ⳣ��(![]() ��
��![]() ��
��![]() )���ɴ�С��˳��Ϊ______��
)���ɴ�С��˳��Ϊ______��
�ڽ�![]() ��
��![]() �������ʵ�����ϣ�һ�������·�Ӧ�ﵽƽ�⣬
�������ʵ�����ϣ�һ�������·�Ӧ�ﵽƽ�⣬![]() ת����Ϊ50%����Ӧǰ��ƽ���������ƽ����Է�������֮��Ϊ______��
ת����Ϊ50%����Ӧǰ��ƽ���������ƽ����Է�������֮��Ϊ______��
��.��![]() ����������
����������![]() ��Һ���ա�
��Һ���ա�
(4)��֪![]() ʱ��
ʱ��![]() ,��
,��![]() �γɵĻ����Һǡ�ó����ԣ���ʱ��Һ������Ũ�ȴ�С˳��Ϊ______��(��֪
�γɵĻ����Һǡ�ó����ԣ���ʱ��Һ������Ũ�ȴ�С˳��Ϊ______��(��֪![]() ʱ��
ʱ��![]() �ĵ���ƽ�ⳣ��
�ĵ���ƽ�ⳣ��![]() ��
��![]() )
)
(5)�ɽ�����Һ��������������ѭ��ʹ�á�����������ͼ��ʾ��a�缫�Ϻ������ŵ�ķ�ӦʽΪ______(��дһ��)�����ӽ���Ĥ______(����)Ϊ�����ӽ���Ĥ��

���𰸡�2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g) ![]() H=-746.5kJ/mol acd < KC>KB>KA 3:2 c(Na+)>(SO32-)>c(HSO3-)> c(H+)=c(OH-) HSO3-+H2O-2e-=SO42-+3H+ c
H=-746.5kJ/mol acd < KC>KB>KA 3:2 c(Na+)>(SO32-)>c(HSO3-)> c(H+)=c(OH-) HSO3-+H2O-2e-=SO42-+3H+ c
��������
(1)���ݷ�Ӧ��ƽ�ⳣ������ʽ�õ���ӦΪ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)�����ݸ�˹���ɣ�����һ�͵���������ʽ����-1���ڶ�������ʽ����2����ӵõ���2NO(g)+2CO(g)
N2(g)+2CO2(g)�����ݸ�˹���ɣ�����һ�͵���������ʽ����-1���ڶ�������ʽ����2����ӵõ���2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=-746.5kJ/mol��
N2(g)+2CO2(g) ��H=-746.5kJ/mol��
�ʴ�Ϊ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=-746.5kJ/mol��
N2(g)+2CO2(g) ��H=-746.5kJ/mol��
(2) a.�����£�ѹǿ���������������ʵ������䣬�÷�Ӧ���������ʵ�����С�ķ�Ӧ������ѹǿ�������֤���ﵽƽ��״̬����a��ȷ��
b.���ʱ�Ӧ�õ��ڷ���ʽ��ϵ���ȣ�����![]() ��(CO)=2
��(CO)=2![]() ��(N2)ʱ����˵����Ӧ�ﵽƽ��״̬����b����
��(N2)ʱ����˵����Ӧ�ﵽƽ��״̬����b����
c.�÷�Ӧ�������ʶ������壬����m�����䣬���ƽ����Է����������䣬����M=![]() ���õ������n�����䣬�÷�Ӧ���������ʵ�����С�ķ�Ӧ������n��������ƽ��״̬����c��ȷ��
���õ������n�����䣬�÷�Ӧ���������ʵ�����С�ķ�Ӧ������n��������ƽ��״̬����c��ȷ��
d.ƽ�ⳣ��ֻ���¶��й���ƽ�ⳣ����������¶Ȳ��䣬���������ȣ�������Ȼ�����¶�һ���仯�������¶Ȳ��䣬˵����Ӧ��ƽ�⣬��d��ȷ��
e.��ʼ�����NO��CO����ȵģ���Ӧ�����߰���1��1���з�Ӧ���������������ߺ㶨��ȣ���e����
�ۺ����Ϸ�����ѡacd��
�ʴ�Ϊ��acd��
(3)������ת��ΪCO��H2�ķ�ӦΪ��ѧ��ѧ��������������ȷ�Ӧ������ѹǿ��ƽ�����淴Ӧ�����ƶ��������¶ȣ�ƽ��������Ӧ�����ƶ�����ͼ��֪����ͬ�¶�ʱ��CH4��ƽ��ת����P1����P2����ѹǿ��СΪP1С��P2��
��ͼ��֪��Ӧ�¶ȵĴ�С˳��Ϊ��C��B��A�����Ӧ��ƽ�ⳣ���ɴ�С��˳��ΪKC>KB>KA��
������ʼCH4��H2O(g)�����ʵ�����Ϊ1mol����������ݽ�����������ʽ��
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
��ʼ����mol�� 1 1 0 0
ת������mol�� 1��50% 1��50% 1��50% 3��50%
ƽ������mol�� 0.5 0.5 0.5 1.5
��Ӧǰ�������������ʵ���Ϊ2mol��������Ϊ34g��ƽ����Է�������Ϊ![]() ��ƽ���������������ʵ���Ϊ3mol��������Ϊ34g��ƽ����Է�������Ϊ
��ƽ���������������ʵ���Ϊ3mol��������Ϊ34g��ƽ����Է�������Ϊ![]() �����������ƽ����Է�������֮��Ϊ3:2��
�����������ƽ����Է�������֮��Ϊ3:2��
�ʴ�Ϊ��<��KC>KB>KA��3:2��
(4)������Һ�����ԣ�c(H+)=c(OH-)=1![]() 10-7mol/L����Һ�д���HSO3-
10-7mol/L����Һ�д���HSO3-![]() H++SO32-����Ka2=
H++SO32-����Ka2=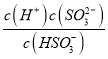 =2.0
=2.0![]() 10-7����c(SO32-)=2c(HSO3-)����(SO32-)>c(HSO3-)����Һ�л����ڵ���غ��ϵ��c(Na+)+c(H+)=2(SO32-)+c(HSO3-)+c(OH-)������c(H+)=c(OH-)������c(Na+)=2(SO32-)+c(HSO3-)�����c(Na+)>(SO32-)���ۺ����Ϸ�������ʱ��Һ������Ũ�ȴ�С˳��Ϊc(Na+)>(SO32-)>c(HSO3-)> c(H+)=c(OH-)��
10-7����c(SO32-)=2c(HSO3-)����(SO32-)>c(HSO3-)����Һ�л����ڵ���غ��ϵ��c(Na+)+c(H+)=2(SO32-)+c(HSO3-)+c(OH-)������c(H+)=c(OH-)������c(Na+)=2(SO32-)+c(HSO3-)�����c(Na+)>(SO32-)���ۺ����Ϸ�������ʱ��Һ������Ũ�ȴ�С˳��Ϊc(Na+)>(SO32-)>c(HSO3-)> c(H+)=c(OH-)��
�ʴ�Ϊ��c(Na+)>(SO32-)>c(HSO3-)> c(H+)=c(OH-)��
(5)������������Һ���ն�������Ӧ�õõ�������������Һ����������������Һ��pH=6������Һ�����������С���ͼ��֪���Ҳ��ǵ��ص�������������Ϊ��ˮ����������ӵõ�������������ʣ���������������������������ӷ�Ӧ�õ�����������ӣ�����ǵ��ص�������cΪ�����ӽ���Ĥ���������������������Ĥ����������������ʧ����ת��ΪSO42-���������Ϊ���ᣬ���������缫��ӦʽΪ��HSO3-+H2O-2e-=SO42-+3H+��
�ʴ�Ϊ��HSO3-+H2O-2e-=SO42-+3H+��c��

����Ŀ��Li4Ti5O12��LiFePO4��������ӵ�صĵ缫���ϣ���������������Ҫ�ɷ�ΪFeTiO3 �� ����������MgO��SiO2�����ʣ����Ʊ��������������£�
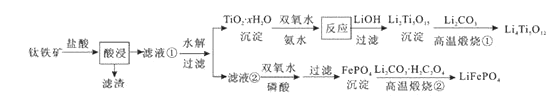
����˵������ȷ���ǣ� ��
A.���������������Ҫ��TiOCl42-��ʽ���ڣ�����Ӧ��Ӧ�����ӷ���ʽ�ɱ�ʾΪ��FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.��Li2Ti5O15��Ti�Ļ��ϼ�Ϊ+4�������й���������ĿΪ3��
C.���������բ�������FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽ�ɱ�ʾΪ��2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O��+3CO2��
2LiFePO4+H2O��+3CO2��
D.TiO2 �� xH2O������˫��ˮ����ˮ��Ӧ40min����ʵ�������±���ʾ��
�¶�/ �� | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
��֪��40 oCǰ��δ�ﵽƽ��״̬�������¶����ߣ�ת���ʱ��40 oC��H2O2�ֽ�Ӿ磬ת���ʽ���



