题目内容
【题目】实验题
Ⅰ.课本实验
(1)苯甲酸的重结晶实验操作步骤是_________、__________、__________、分离晶体,粗苯甲酸溶解后还要加点水的目的是________________。
(2)为了验证溴乙烷中含有溴元素,有以下操作:①加硝酸银溶液 ②加NaOH溶液 ③加热 ④加蒸馏水 ⑤加硝酸至溶液显酸性,合理的顺序是(______)
A、②①③⑤ B、②④⑤③ C、②③⑤① D、②①⑤③
(3)在溴乙烷与NaOH乙醇溶液的消去反应中可以观察到有气体生成。有人设计了实验方案来检验生成的气体是否为乙烯,如图所示。

①Ⅰ中水的作用____________。
②Ⅱ中还可用________________,若用此物质,此时______(填“有”或“无”)必要将气体先通入水中。
Ⅱ.拓展实验
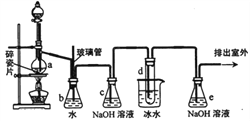
1,2一二溴乙烷可作抗爆剂的添加剂。下图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴。
已知:
相关数据列表如下:

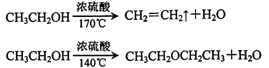
(1)实验中应迅速将温度升高到170℃左右的原因是__________________。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中导管d是否发生堵塞,请写出发生堵塞时瓶b中的现象__________________;如果实验中导管d堵塞,你认为可能的原因是__________________;安全瓶b还可以起到的作用是___________________________;
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________;
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因___________________________;
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为_______,要进一步提纯,下列操作中必须的是__________________(填入正确选项前的字母)。
A. 重结晶 B.过滤 C.萃取 D.蒸馏
【答案】 加热溶解 趁热过滤 冷却结晶 减少苯甲酸的损失 C 除去乙醇 溴水 无 减少副产物乙醚生成 b中长直玻璃管内有一段液柱上升 过度冷却,产品1 , 2-二溴乙烷在装置d中凝固 防止倒吸 吸收乙烯气体中含有的CO2、SO2等酸性气体 发生副反应生成乙醚或乙醇挥发 或乙烯流速过快,未完全发生加成反应 乙醚 D
【解析】本题考查实验方案设计与评价,I.(1)苯甲酸的重结晶实验操作步骤是先加热溶解,然后趁热过滤,冷却结晶,然后根据过滤,洗涤;粗苯甲酸溶解后还要加点水的目的是减少本就哎算的损失;(2)验证溴乙烷种溴元素,首先让溴元素转化成Br-,即将溴乙烷加入到NaOH溶液中并加热,加热一段时间后,冷却,加硝酸至溶液显酸性,再加入AgNO3溶液,出现淡黄色沉淀,说明溴乙烷种含有溴元素,正确的顺序是②③⑤①,故选项C正确;(3)①溴乙烷与氢氧化钠的乙醇溶液反应需要加热,加快反应速率,但乙醇以挥发,气体中混有乙醇,乙醇也能使酸性高锰酸钾溶液褪色,因此必须除去乙醇,即I中水的作用是除去乙醇;②乙烯能使溴水褪色,因此II中可以用溴水代替,乙醇不与溴水反应,乙醇不能使溴水褪色,因此不要将其踢先通入水中,应填“无”;II.(1)根据已知,在加热到140℃时会产生乙醚,因此要让温度迅速升高到170℃左右,目的是减少副产物乙醚的生成;(2)导管d发生堵塞,造成a、b、c中气体压强增大,即b中长直玻璃管内有一段液柱上升;冰水的温度为0℃,根据表格中数据,1,2-二溴乙烷的熔点为9.79℃,使1,2-二溴乙烷由液体转化成固体,堵塞导管d;安全瓶b还起到防倒吸的作用;(3)浓硫酸具有脱水性,能使乙醇碳化,C和浓硫酸在加热条件下发生反应生成CO2和SO2,c中NaOH溶液作用是吸收乙烯气体中含有的CO2、SO2等酸性气体;(4)发生副反应生成乙醚或乙醇挥发或乙烯流速过快,未完全发生加成反应;(5)升高到170℃时,必定经过140℃,会产生乙醚,因此杂质为乙醚,利用乙醚和1,2-二溴乙烷的沸点不同,采用蒸馏的方法,故选项D正确。