题目内容
 (1)现有含Fe2O380%的赤铁矿100t,理论上可冶炼含Fe95%的生铁多少吨?
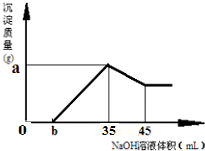
(1)现有含Fe2O380%的赤铁矿100t,理论上可冶炼含Fe95%的生铁多少吨?(2)准确称取6g铝土矿(含Fe2O3、Al2O3)样品,放入盛有100mLHCl的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀的量与所加NaOH溶液的体积的关系如图所示.试求:
①盐酸的物质的量浓度是多少?
②若b=2.3,则铝土矿中氧化铝的质量分数是多少?
分析:Fe2O3、Al2O3 均能溶于盐酸,根据加入氢氧化钠后过一段时间才出现沉淀可知,盐酸是过量的,Fe2O3、Al2O3 均已完全反应;当加入35ml氢氧化钠时,溶液中的溶质只有NaCl,即Na+和 Cl-物质的量相等,从而就能求出盐酸的物质的量及物质的量浓度; 根据溶解氢氧化铝消耗10ml NaOH溶液,就能知Al(OH)3的物质的量,从而就能求出氧化铝的质量以及在混合物中的质量分数.
解答:解:(1)由题目可知,m( Fe2O3)═100t×80%═80t
冶炼得到的铁的质量:m(Fe)═80t×(112÷160)═56t
故得到的含Fe95%的生铁的质量为:m═56t÷95%═58.9t
答:得到含Fe95%的生铁的质量为58.9t.
(2)由图象可知,加入氢氧化钠后过一段时间才出现沉淀,可知盐酸是过量的,Fe2O3、Al2O3 均已完全反应为FeCl3、AlCl3,溶液中的溶质为:FeCl3、AlCl3、HCl.
待加入NaOH溶液35ml时,Fe3+、Al3+已恰好完全沉淀,溶液中的溶质只有NaCl,即n( Cl-)═n(Na+),∴n(HCl)═n(NaOH)═10mol?L-1×0.035L═0.35mol
∴c(HCl)═0.35mol÷0.1L═3.5mol?L-1
答:盐酸溶液的浓度为3.5mol?L-1
(3)由图象可知,生成的氢氧化铝溶解消耗的NaOH为10ml,设Al(OH)3为 x mol
Al(OH)3 ~NaOH
1 mol 1 mol
x mol 10mol?L-1×0.01L
解得x═0.1 mol
而 2Al(OH)3 ~Al2O3 由此可知,n(Al2O3)═0.05 mol
铝土矿中 Al2O3 的质量分数ω%═0.05 mol×102g/mol÷6g×100%═85%
答:铝土矿中 Al2O3 的质量分数为85%.
冶炼得到的铁的质量:m(Fe)═80t×(112÷160)═56t
故得到的含Fe95%的生铁的质量为:m═56t÷95%═58.9t
答:得到含Fe95%的生铁的质量为58.9t.
(2)由图象可知,加入氢氧化钠后过一段时间才出现沉淀,可知盐酸是过量的,Fe2O3、Al2O3 均已完全反应为FeCl3、AlCl3,溶液中的溶质为:FeCl3、AlCl3、HCl.
待加入NaOH溶液35ml时,Fe3+、Al3+已恰好完全沉淀,溶液中的溶质只有NaCl,即n( Cl-)═n(Na+),∴n(HCl)═n(NaOH)═10mol?L-1×0.035L═0.35mol
∴c(HCl)═0.35mol÷0.1L═3.5mol?L-1
答:盐酸溶液的浓度为3.5mol?L-1
(3)由图象可知,生成的氢氧化铝溶解消耗的NaOH为10ml,设Al(OH)3为 x mol
Al(OH)3 ~NaOH
1 mol 1 mol
x mol 10mol?L-1×0.01L
解得x═0.1 mol
而 2Al(OH)3 ~Al2O3 由此可知,n(Al2O3)═0.05 mol
铝土矿中 Al2O3 的质量分数ω%═0.05 mol×102g/mol÷6g×100%═85%
答:铝土矿中 Al2O3 的质量分数为85%.
点评:本题考查了关乎实际工业生产的计算和有关铝的化合物的图象问题,综合性较强,难度较大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 下表是元素周期表的一部分.表中所列的编号分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的编号分别代表一种化学元素.