题目内容
8.短周期主族元素M、N、X、Y、Z的原子序数依次增大.已知M与X同主族,N原子的最外层电子数是电子层数的3倍,M原子的原子半径小于N原子的原子半径,Z的原子半径在同周期元素中是最小的,Y原子的电子层数与最外层电子数相等.下列叙述正确的是( )| A. | 单质的还原性:Y>X | |
| B. | 元素M与N能形成的共价化合物不止一种 | |
| C. | 通常状况下,元素Z的单质不能与元素M的氧化物反应 | |
| D. | 元素X、Y、Z的最高价氧化物对应的水化物彼此间均可发生反应 |
分析 短周期主族元素M、N、X、Y、Z的原子序数依次增大.N原子的最外层电子数是电子层数的3倍,2个电子层符合电子排布规律,最外层电子数为6,则N为O;M原子的原子半径小于N原子的原子半径,原子序数M<N,则M为H;已知M与X同主族,结合原子序数可知X为Na;Z的原子半径在同周期元素中是最小的,Z为Cl,Y原子的电子层数与最外层电子数相等,Y为Al,以此来解答.
解答 解:由上述分析可知,M为H,N为O,X为Na,Y为Al,Z为Cl,
A.同周期从左向右金属性减弱,还原性减弱,则单质的还原性:Y<X,故A错误;
B.元素M与N能形成的共价化合物有H2O、H2O2等,故B正确;
C.通常状况下,元素Z的单质为氯气,元素M的氧化物为水,二者反应生成盐酸、次氯酸,故C错误;
D.元素X、Y、Z的最高价氧化物对应的水化物分别为NaOH、氢氧化铝、高氯酸,氢氧化铝具有两性,则彼此间均可发生反应,故D正确;
故选BD.
点评 本题考查原子结构与元素周期律,为高频考点,把握电子排布规律、原子结构、原子序数、元素的性质来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
11.下列不属于有机化合物的是( )
| A. | 甲烷 | B. | 甲醛 | C. | 乙酸 | D. | 二氧化碳 |
16.下列有关化学用语表述正确的是( )
| A. | 羟基的电子式: | B. | 乙酸的最简式:CH3COOH | ||
| C. | 苯甲醛的结构简式: | D. |  的系统命名为:4,4二甲基-2-戊烯 的系统命名为:4,4二甲基-2-戊烯 |
13.下列属于同位素的是( )
| A. | O2和O3 | B. | H和D | C. | H2O和D2O | D. | 石墨和金刚石 |
20.五种短周期主族元素W、X、Y、Z、R的原子序数依次增大,W与X的原子序数之和等于Y 的原子序数,X、Y同周期,Z的单质与冷水能剧烈反应生成W的单质,R的简单离子在同周期元素的简单离子中半径最小,W2Y2常温下为一种液态化合物.下列说法正确的是( )
| A. | 原子半径为W<X<Y<Z<R | |
| B. | 2 mol Z单质投入足量W2Y中,电子转移数为2×6.02×1023 | |
| C. | 电解熔融状态的R的氯化物,可制得R的单质 | |
| D. | W、X、Y三种元素不能组成离子化合物 |
17.下列有机物的命名正确的是( )
| A. |  1,3,4-三甲苯 1,3,4-三甲苯 | |
| B. |  3-乙基-1-丁烯 3-乙基-1-丁烯 | |
| C. | 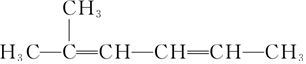 2-甲基-2,4-己二烯 2-甲基-2,4-己二烯 | |
| D. |  2,4,4-三甲基戊烷 2,4,4-三甲基戊烷 |
 在一密闭容器中发生反应N2+3H2?2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示
在一密闭容器中发生反应N2+3H2?2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示 它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷.
它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷.