题目内容
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其它化学试剂进行如下操作,得到了Fe2O3、Al2O3和金属Cu。
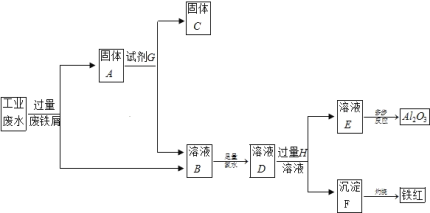
请回答:
(1)固体A的成分是____________(用化学式表示)。
(2)溶液B→沉淀F的现象是_______________,用化学方程式表示沉淀产生此现象的原理_______。
(3)写出下列反应的离子方程式:反应①中Fe3+发生的反应:_____________,D→E:__________。
(4)小明认为由溶液B→溶液D的过程并不符合绿色化学,所以将氯水换成了H2O2溶液,在该转化过程中若转移2mol 电子,则消耗质量分数为30%的H2O2溶液的质量为________g(精确到0.1g)。
【答案】Fe、Cu 白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe+2Fe3+=3Fe2+ Al3++4OH-=AlO2-+2H2O 113. 3
【解析】
由废水中含Fe3+、Al3+、Cu2+,加入过量铁粉后,发生2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu,所以固体A为Cu和Fe,溶液B为FeCl2,再加足量的氯水,溶液D为FeCl3溶液,再加过量的氢氧化钠溶液,生成沉淀F为Fe(OH)3,溶液E为NaAlO2,以此解答。
(1)根据流程图中可以知道,完成回收铁红、Al2O3和金属Cu,先加过量铁粉,2Fe3++Fe=3Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来Cu2++Fe=Fe2++Cu,过滤得到Fe、Cu,故答案为:Fe、Cu;
(2)过滤所得溶液B中含有Al3+、Fe2+,沉淀F为Fe(OH)3,所以溶液B→沉淀F的现象是先产生白色沉淀迅速变成灰绿色,最终变成红褐色,发生的反应为: 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ;答案:白色沉淀迅速变成灰绿色,最终变成红褐色; 4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)废水中含Fe3+、Al3+、Cu2+,反应①中Fe3+具有强氧化性,能和铁发生氧化还原反应,发生反应的离子方程式:Fe+2Fe3+=3Fe2+,溶液B中含有Al3+、Fe2+,加氯水后,+2价的铁离子被氯水氧化2Fe2++Cl2=2Fe3++2Cl-,溶液D中含有Al3+、Fe3+,加入过量的NaOH溶液后,会产溶液E的反应为,Al3++4OH-=AlO2-+2H2O;答案:Fe+2Fe3+=3Fe2+;Al3++4OH-=AlO2-+2H2O;
(5)1mol双氧水得到2mol电子,该转化过程中若转移2mol电子,则消耗双氧水是1mol质量是34g,所以消耗质量分数为30%的H2O2溶液的质量为![]() =113.3g;答案:113.3。
=113.3g;答案:113.3。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、FeO、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如图:
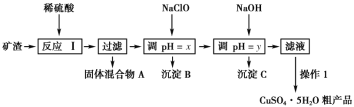
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是__(任写1条)。
(2)固体混合物A中的成分是__。
(3)反应Ⅰ完成后,铁元素的存在形式为__(填离子符号);检验该离子常用的方法之一是:取少量含该离子的溶液于试管中,滴加几滴铁氰化钾溶液,会产生沉淀,写出该反应的离子方程式__。
(4)操作1主要包括:__、__、__。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是__。
(5)用NaClO调pH可以生成沉淀B,利用题中所给信息分析沉淀B为__,该反应中氧化剂与还原剂的物质的量之比为__。
(6)用NaOH调pH可以生成沉淀C,利用题中所给信息分析y的范围为__。